(12分)“问题胶囊”事件引发了各方关注和热议 国际食品包装协会秘书长董金狮教授说:“工业明胶中重金
(12分)“问题胶囊”事件引发了各方关注和热议,国际食品包装协会秘书长董金狮教授说:“工业明胶中重金属铬的毒性远高于三聚氰胺”。铬是严重的致癌物质,绝不允许含铬废水随意排放。请回答下列问题: 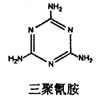 (1)三聚氰胺中N原子的杂化方式是 . (2)酸性溶液中过氧化氢能使Cr2072-生成蓝色的过氧化铬(CrO5,分子结构为 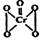 ),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为 , 请写出反应的离子方程式: 。 ),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为 , 请写出反应的离子方程式: 。(3)一种治理含Cr2072-酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2072-被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准。 ①加适量食盐的目的是 ,与Cr(OH)3沉淀同时生成的沉淀还可能有 。 ②已知电解后溶液中c(Fe3+)为4.Ox10-13mol.L-1,则溶液中c(Cr3+)浓度为 。 (已知KsP[Fe(OH)3]=4.0×10-38; Ksp[Cr(OH)3]=6.0×10-31) |
参考解答
| (1)sp2和sp3(2分) (2)+6 4H2O2+Cr2O72-+2H+='=' 2CrO5+5H2O (3)①增大离子浓度,增强导电能力 Fe(OH)3 ② 6.0×10-6 mol·L-1 |
| (1)根据结构简式可知,环上的氮原子形成1个单键和1个双键,所以是sp2杂化;而氨基中的氮原子全部是单键,因此是sp3杂化。 (2)根据结构简式可知,分子中含有2个过氧链,所以铬原子的化合价是+6价,反应的离子方程式为4H2O2+Cr2O72-+2H+='=' 2CrO5+5H2O。 (3)①氯化钠是强电解质,加入氯化钠能增大离子浓度,增强导电能力;由于铁作阳极,失去电子生成亚铁离子,然后亚铁离子被氧化生成铁离子,最终得到氢氧化铁沉淀。 ②根据KsP[Fe(OH)3=4.0×10-38; Ksp[Cr(OH)3=6.0×10-31可知,当c(Fe3+)为4.Ox10-13mol.L-1时,溶液中 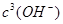 =1.0x10-25mol.L-1,所以溶液中c(Cr3+)浓度=6.0×10-6 mol·L-1。 =1.0x10-25mol.L-1,所以溶液中c(Cr3+)浓度=6.0×10-6 mol·L-1。 |
相似问题
下列说法正确的是 A.阳离子只有氧化性 阴离子只有还原性B.失电子难的原子获得电子的能力一定强C.得
下列说法正确的是 A.阳离子只有氧化性,阴离子只有还原性B.失电子难的原子获得电子的能力一定强C.得到电子越多的氧化剂,其氧化性就越强D.要实现Fe2
(14分)用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl ='2KCl' +2MnC
(14分)用浓盐酸来制取氯气的化学方程式如下:2KMnO4 +16HCl ="2KCl" +2MnCl2 + 5Cl2↑+8H2O,其中被还原的元素是,被氧化的元素是,氧化剂是,还
在下列变化中 需要加入合适的还原剂才能实现的是 A.H2→HClB.
在下列变化中,需要加入合适的还原剂才能实现的是A.H2→HClB.CO→CO2 C.FeCl3→ FeCl2D.SO2→SO3
在含2 mol H2 SO4的浓H2 SO4溶液中加入足量的Zn粉 使其充分反应 则下列推断中错误的
在含2 mol H2 SO4的浓H2 SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是() ①放出的气体中除SO2外还有H2; ②反应结束时转移电子
(4分)Ca(ClO)2与浓盐酸反应会生成Cl2 该反应的化学方程式为: Ca(ClO)2 + 4
(4分)Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为: Ca(ClO)2 + 4HCl(浓)= CaCl2 + 2Cl2↑+ 2H2O⑴浓盐酸在反应中显示出来的性质是(












