KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯 其化学方程式为:2KClO3+4HC
| KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O.(ClO2中氯元素的化合价为+4价) (1)浓盐酸在反应中表现出来的性质是______(填写编号) ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (2)产生0.1molCl2,则转移电子的物质的量为______mol. (4)用双线桥法标出该反应的电子转移的方向和数目______. |
参考解答
| (1)在反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又该反应生成盐KCl,则表现酸的酸性, 故答案为:②; (2)由反应可知,氯酸钾中Cl元素的化合价由+5降低为+4,则2molKClO3反应转移的电子数为2mol×(5-4)=2mol, 即生成1molCl2转移电子的物质的量2mol,则产生0.1molCl2转移电子的物质的量0.2mol,故答案为:0.2; (3)该反应中KClO3中氯元素化合价由+5得一个电子变成+4价,HCl中氯元素由-1价失一个电子变成0价,转移电子数是2,可表示为 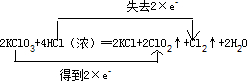 , 故答案为: 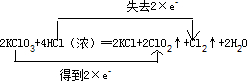 . |
相似问题
利用碱性氧化性溶液的氧化作用 在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜
利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝.烤蓝时发生如下
一个完整的氧化还原反应方程式可以拆开写成两个“半反应式” 一个是“氧化反应”式 一个是“还原反应”式
一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:氧化
亚硝酸(HNO2)既可作氧化剂又可作还原剂 当它在反应中作氧化剂时 可能生成的产物是( )A.N2
亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是( )A.N2O5B.N2O3C.NH3D.NO2
氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+
氮化硅(Si3N4)是一种具有耐高温等优异性能的新型陶瓷.工业上可用下列方法制取:3SiO2+6C+2N2 ?Si3N4+6CO.下列说法正确的是( )A.在氮化硅的合
右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )A.该系统中只存在3种形式的能量转化
右图是一种航天器能量储存系统原理示意图.下列说法正确的是( )A.该系统中只存在3种形式的能量转化B.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH












