漂白粉是一种常用杀菌 消毒剂 其有效成分为次氯酸钙.如图为制取漂白粉的工业流程简图.(1)流程 I
漂白粉是一种常用杀菌、消毒剂,其有效成分为次氯酸钙.如图为制取漂白粉的工业流程简图.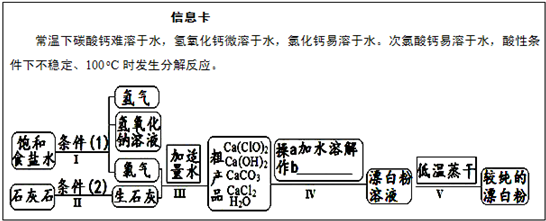 (1)流程 I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是______ mol?L-1. (2)写出流程 I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:______.流程 II的反应条件(2)是______. (3)流程 III中发生两个反应,写出其中一个的氧化还原反应的化学反应方程______. (4)流程 IV中操作b是:______.(写名称) (5)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因______. |
参考解答
(1)物质的量浓度c=
(2)电解饱和食盐水的反应为化:2NaCl+2H2O
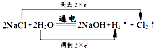 ,碳酸钙在高温下会分解,故答案为: 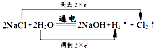 ;高温; (3)有元素化合价变化的反应为氧化还原反应,流程III中发生两个反应,一个是氯气和氢氧化钙反应生成氯化钙、水以及次氯酸钙的反应,即2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,属于氧化还原反应,一个是次氯酸钙和水以及二氧化碳反应生成碳酸钙和次氯酸的反应,即Ca(ClO)2+CO2+H2O═CaCO3+2HClO,属于复分解反应,一定不是氧化还原反应, 故答案为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O; (4)流程IV中加水溶解后过滤可以实现固体难溶物和液体的分离,故答案为:过滤; (5)较纯的次氯酸钙粉末必须密封保存,因为氯酸钙以和空气中的水以及二氧化碳反应而变质,即Ca(ClO)2+CO2+H2O═CaCO3+2HClO,故答案为:Ca(ClO)2+CO2+H2O═CaCO3+2HClO. |
相似问题
钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程.化学方程式①②③表示钢铁“发蓝”的变化原理
钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程.化学方程式①②③表示钢铁“发蓝”的变化原理,下列说法不正确的是( )①3Fe+NaNO2+5Na
下列说法中正确的是( )A.氧化反应和还原反应一定是同时发生的B.氧化剂是一种能失去电子的物质C.
下列说法中正确的是( )A.氧化反应和还原反应一定是同时发生的B.氧化剂是一种能失去电子的物质C.物质所含元素化合价升高的反应是还原反应D.氧化
下列变化需要加入氧化剂才能实现的是( )A.CaCO3→CO2B.KMnO4→O2C.HCl→Cl
下列变化需要加入氧化剂才能实现的是( )A.CaCO3→CO2B.KMnO4→O2C.HCl→Cl2D.H2SO4→H2
下列说法正确的是( )A.稀H2SO4能导电 所以稀H2SO4是电解质B.氧化还原反应中有一种元素
下列说法正确的是( )A.稀H2SO4能导电,所以稀H2SO4是电解质B.氧化还原反应中有一种元素化合价升高必定有另一种元素化合价降低C.根据是否有丁达尔
判断给定化学反应是否为氧化还原反应的依据是( )A.看反应前后是否有氧原子的得失B.看反应前后是否
判断给定化学反应是否为氧化还原反应的依据是( )A.看反应前后是否有氧原子的得失B.看反应前后是否有原子的重新组合C.看反应后是否有气体生成D.












