过量铁粉与稀硝酸反应的方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O ①
| 过量铁粉与稀硝酸反应的方程式为:3Fe+8HNO3(稀)═3Fe(NO3)2+2NO↑+4H2O, ①标出电子转移的方向和数目______ ②该反应的氧化剂是______,还原产物是______; ③标准状况下,当生成2.24LNO气体时,有______gFe参加反应,转移电子的物质的量为______,有______mol氧化剂被还原. |
参考解答
①Fe元素的化合价由0升高为+2价,硝酸中N元素的化合价由+5价降低为+2价,该反应中3molFe反应生成6mol电子,则电子转移方向和数目为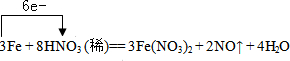 , ,故答案为: 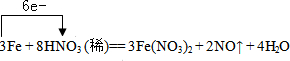 ; ;②N元素的化合价降低,则HNO3为氧化剂,还原产物为NO,故答案为:HNO3;NO; ③标准状况下,当生成2.24LNO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,由N原子守恒可知,0.1mol氧化剂被还原,参加反应的Fe我0.1mol×
|
相似问题
在一定条件下 氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO下列说法正确的是(
在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO下列说法正确的是( )A.氧化剂是Al2O3B.还原剂是N2C.碳元素被还原D.生成1molCO,转移的电子数为2NA
下列是海水综合应用中提取镁 溴的反应 属非氧化还原反应的是( )A.苦卤中加入石灰乳MgCl2+C
下列是海水综合应用中提取镁、溴的反应,属非氧化还原反应的是( )A.苦卤中加入石灰乳MgCl2+Ca(OH)2=CaCl2+Mg(OH)2B.苦卤中通入氯气2Br-+Cl2=2
在H+ Mg2+ Fe2+ Fe3+ S2- I- S中 只有氧化性的是______ 只有还原性的是
在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S中,只有氧化性的是______,只有还原性的是______,既有氧化性又有还原性的是______.
煤和石油燃烧时除产生二氧化碳外 还产生二氧化硫.氮的氧化物和硫的氧化物排放到空气中是形成酸雨的主要物
煤和石油燃烧时除产生二氧化碳外,还产生二氧化硫.氮的氧化物和硫的氧化物排放到空气中是形成酸雨的主要物质.酸雨形成时,主要发生下列反应:①N2+O2放
在反应2H2+O2点燃.2H2O中 O2是( )A.还原剂B.既是氧化剂又是还原剂C.氧化剂D.既
在反应2H2+O2点燃 2H2O中,O2是( )A.还原剂B.既是氧化剂又是还原剂C.氧化剂D.既不是氧化剂也不是还原剂












