已知实验室制氯气的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 其中(1)
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中 MnCl2+Cl2↑+2H2O,其中(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”) (2) HCI中氯原子___________(填“得到”或“失去”)电子。 (3)反应中还原剂与氧化剂的物质的量之比为______________。 (4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
参考解答
| (6分)(1)还原(1分) (2)失去(1分) (3)2:1 (2分) (4) 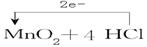 (2分) (2分) |
试题分析:(1)根据反应方程式可知,二氧化锰中Mn元素的化合价从+4价降低到+2价,被还原。 (2)氯化氢中氯元素的化合价从-1价升高到0价,因此失去电子。 (3)1mol氧化剂二氧化锰得到2mol电子,1mol还原剂氯化氢失去1mol电子,因此反应中还原剂与氧化剂的物质的量之比为2:1。 (4)反应中氯化氢是还原剂,二氧化锰是氧化剂,转移2mol电子,因此电子转移情况为 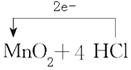 。 。 |
相似问题
我国是个钢铁大国 钢铁产量为世界第一 高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:C(s)+
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:C(s)+O2(g)=CO2(g)ΔH1=-393 5kJ mol①C(s)+ CO2(g)
在方程式4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O的反应中 当有1 m
在方程式4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O的反应中,当有1 mol电子转移时,以下说法错误的是A.有1 2 mol硫原子被还原B.有1 3 mol氮原子被
(6分)金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O
(6分)金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2=+2FeS+SO2,(方程式已配平)(1)方框中的物质应为___
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑ ;②Cu+2H2SO4
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题:⑴反应①中元素被还原,反应②中元
为了防止枪支生锈 常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3SO4的致密的保护层——“发蓝”。主要反应如①












