某温度下 将Cl2通入KOH溶液里 反应后得到KCl KClO KClO3的混合溶液.经测定ClO-
某温度下,将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液.经测定ClO-与ClO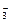 的物质的量浓度之比是1:2,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是 的物质的量浓度之比是1:2,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是
|
参考解答
| D |
| 由已知条件及质量守恒定律写出方程式: 7Cl2+14KOH====11KCl+KClO+2KClO3+7H2O 被氧化的氯为3 mol,被还原的氯为11 mol.即知被还原的氯元素与被氧化的氯元素的物质的量之比为11:3. |
相似问题
下列说法正确的是( )A.新制氯水是混合物 久置氯水是纯净物B.氯气在氢气中燃烧生成的气体溶于水中
下列说法正确的是( )A.新制氯水是混合物,久置氯水是纯净物B.氯气在氢气中燃烧生成的气体溶于水中形成盐酸C.次氯酸钙比次氯酸不稳定D.漂白粉的
小强同学为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.将一根玻璃管与氯气发生器相连
小强同学为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤
下列说法正确的是( )A.浓硝酸在光照下变黄 证明硝酸不稳定 且产物有红棕色气体可溶于浓硝酸B.向
下列说法正确的是( )A.浓硝酸在光照下变黄,证明硝酸不稳定,且产物有红棕色气体可溶于浓硝酸B.向某溶液中加入氯化钡溶液和稀硝酸,生成白色沉淀
下列说法中 不正确的是( )A.光照氯水时有气泡逸出 该气体是Cl2B.燃煤时加入适量石灰石 可减
下列说法中,不正确的是( )A.光照氯水时有气泡逸出,该气体是Cl2B.燃煤时加入适量石灰石,可减少废气中SO2的量C.NH3易液化,液氨常用作制冷剂D.
下列各组物质 都能与水反应且生成物都能溶于水的是( )A.NH3 Cl2B.Na2O2 SO3C.
下列各组物质,都能与水反应且生成物都能溶于水的是( )A.NH3、Cl2B.Na2O2、SO3C.NO、NO2D.Mg、Al












