X Y Z W R是元素周期表前四周期中的常见元素 其相关信息如下表:元素相关信息X组成蛋白质的基础
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。 (2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。 (3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。 (4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。 (5)Z  W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 |
参考解答
| (1)第三周期ⅢA族 Mg>Al>N>O (2) 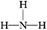 H∶ H∶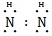 ∶H 离子键 ∶H 离子键(3)33 H3AsO4 NH3>PH3>AsH3 (4)2Fe3++Cu  2Fe2++Cu2+ KSCN溶液 溶液呈红色 2Fe2++Cu2+ KSCN溶液 溶液呈红色(5)52 mol |
蛋白质主要含有C、H、O、N等元素,由化合价可知X为N;Y为O、Z为Mg、W为Al、R为Fe;(2)氮原子最外层有5个电子,每个氢原子形成3个共价键,所以N2H4的结构式为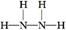 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。 |
相似问题
.我国稀土资源丰富。下列有关稀土元素与的说法正确的是A.与互为同位素B.与的质量数相同C.与是同一种
我国稀土资源丰富。下列有关稀土元素与的说法正确的是A.与互为同位素B.与的质量数相同C.与是同一种核素D.与的核外电子数和中子数均为62
氮可以形成多种离子 如N3- N3- NH2- NH4+ N2H5+ N2H62+等 已知N2H5+
氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质。⑴ 1个N3-离子
19世纪门捷列夫的突出贡献是A.提出了原子学说B.提出了分子学说C.发现了稀有气体 D.发现了元素周
19世纪门捷列夫的突出贡献是A.提出了原子学说B.提出了分子学说C.发现了稀有气体 D.发现了元素周期律
下列说法中 不符合ⅦA族元素性质特征的是A.从上到下原子半径逐渐减小B.易形成-1价离子C.最高价氧
下列说法中,不符合ⅦA族元素性质特征的是A.从上到下原子半径逐渐减小B.易形成-1价离子C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱
在元素周期表短周期元素中 X元素与Y Z W三元素相邻 X Y的原子序数之和等于Z的原子序数 这四种
在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是A












