(14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:①NiO Fe
| (14分)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题: ①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点FeO NiO (填“<”或“>”); ②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为 。 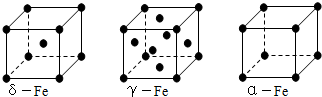 (2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的强相互作用是 ; (3)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。 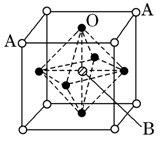  ①用A、B、O表示这类特殊晶体的化学式: 。 ②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: 。 ③下列有关说法正确的是 。 A.镧、锰、氧分别位于周期表f、d、p区 B.氧的第一电离能比氮的第一电离能大 C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强 D.铬的堆积方式与钾相同,则其堆积方式如图所示 |
参考解答
| (1)①< ② 4:3 (2) 3∶1 金属键 (3) ①ABO3 ② (1-x)∶x ③ AC |
试题分析:(1)①NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高。由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。 ②该晶胞中顶点上含有的原子数= 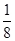 ×8=1,面心上含有的原子数= ×8=1,面心上含有的原子数=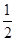 ×6=3,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3。 ×6=3,所以一个晶胞中含有4个原子;δ、α两种晶胞中铁原子的配位数分别是8个和6个,所以δ、α两种晶胞中铁原子的配位数之比是4:3。(2)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6× 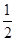 =3,Au原子处于顶点位置,N(Au)=8× =3,Au原子处于顶点位置,N(Au)=8×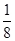 =1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键。 =1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键。(3)①由图1可知,晶胞中A位于顶点,晶胞中含有A为8× 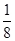 =1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6× =1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×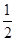 =3,则化学式为ABO3。 =3,则化学式为ABO3。②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1?x)+2x+3m+4n=6、m+n=1,解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x)∶x。 ③A、由金属在周期表中的位置可知镧、锰、氧分别位于周期表f、d、p区,故A正确;B、氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,故B错误;C、元素的电负性越强,金属性越弱,故C正确;D、图中堆积方式为镁型,故D错误,故答案为:A C。 |
相似问题
硒被誉为“生命的奇效元素” 富硒食品倍受追捧 重庆多地打造富硒农产品基地。已知硒元素与氧元素同族 与
硒被誉为“生命的奇效元素”,富硒食品倍受追捧,重庆多地打造富硒农产品基地。已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述错误的是( )A
(11分)A B C D四种短周期元素。原子序数依次增大 A原子的最外层上有4个电子;B的阴离子和C
(11分)A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成
应用元素周期律和元素周期表 判断下列说法正确的是( )A.碱金属单质的熔点随原子序数的增大而降低
应用元素周期律和元素周期表,判断下列说法正确的是()A.碱金属单质的熔点随原子序数的增大而降低B.砹(At)是VIIA族元素,HAt的稳定性大于HClC.第2
(10分)下表为元素周期表的一部分 所标的字母各代表一种化学元素。试回答下列问题:(1)元素M在第_
(10分)下表为元素周期表的一部分,所标的字母各代表一种化学元素。试回答下列问题:(1)元素M在第________周期第________族。(2)C的10电子氢化物的电
W X Y Z是短周期元素 其部分性质如下表下列说法正确的是A.气态氢化物的热稳定性:X>WB.
W、X、Y、Z是短周期元素,其部分性质如下表下列说法正确的是A.气态氢化物的热稳定性:X>WB.最高价氧化物对应水化物的酸性:Y>XC.离子半径:Z>WD.Z












