食盐中含有一定量的镁 铁等杂质 加碘盐中碘的损失主要是由于杂质 水分 空气中的氧气以及光照 受热而引
| 食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知: 氧化性:IO3->Fe3+>I2;还原性:S2O32->I- 3I2+6OH-=IO3-+5I-+3H2O;KI+I2 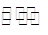 KI3 KI3(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。 ①加KSCN溶液后显红色,该红色物质是_____________(用化学式表示);CCl4中显紫红色的物质是___________(用电子式表示)。 ②第二份试液中加入足量KI固体后,反应的离子方程式为_______________________________________、__________________________________________________________________。 (2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。 写出潮湿环境下KI与氧气反应的化学方程式:_____________________。 将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?___________ (填“是”或“否”),并说明理由_________________________________________________。 (3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是_______。
|
参考解答
(1)①Fe(SCN)3(合理均可)  ②IO3-+5I-+6H+=3I2+3H2O 2Fe3++2I―=2Fe2++I2 (2)4KI+O2+2H2O=2I2+4KOH 否 KI3受热(或潮湿)条件下产生KI和I2,KI易被O2氧化,I2易升华(答案合理即可) (3)A、C (4)取适量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如氯水、H2O2等),再加KSCN溶液,若显红色,则该加碘盐中存在Fe2+ |
| (1)①Fe3+与SCN-的配合物有多种,如[Fe(SCN)]2+、[Fe(SCN)6]3-等;I2的CCl4溶液显紫红色。②应用信息:“氧化性:IO3->Fe3+>I2”,说明IO3-和Fe3+均能氧化I-生成I2。 (2)KI易被潮湿空气氧化,不能写成I-+O2+H+  ,要联系金属吸氧腐蚀,产物I2+KOH不合理(会反应),应考虑缓慢反应,微量产物I2会升华和KOH与空气中的CO2反应。 ,要联系金属吸氧腐蚀,产物I2+KOH不合理(会反应),应考虑缓慢反应,微量产物I2会升华和KOH与空气中的CO2反应。KI3·H2O作加碘剂问题比较难分析,因为KI3很陌生。从题中:“低温条件下可制得”或生活中并无这一使用实例来确定。再根据信息:“KI+I2 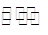 KI3”解释其不稳定性。(3)根据信息“还原性:S2O32->I-”可判断A可作稳定剂,C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起的,加Na2CO3能使之转化为难溶物,防止因其水解显酸性,造成碘损失;D中NaNO2能氧化I-。 KI3”解释其不稳定性。(3)根据信息“还原性:S2O32->I-”可判断A可作稳定剂,C比较难分析,应考虑食盐潮解主要是Mg2+、Fe3+引起的,加Na2CO3能使之转化为难溶物,防止因其水解显酸性,造成碘损失;D中NaNO2能氧化I-。(4)实验方案简答要注意规范性,如“取……加入……现象……结论……”,本实验I―对Fe2+的检验有干扰,用过量氯水又可能氧化SCN-。 |
相似问题
向等物质的量浓度的NaHCO3和Ca(HCO3)2的混合溶液中 加入一定量NaOH溶液时 不可能发生
向等物质的量浓度的NaHCO3和Ca(HCO3)2的混合溶液中,加入一定量NaOH溶液时,不可能发生的离子反应方程式是 ( )。A.OH-+HCO3—=CO32—+H2OB.Ca2
下列离子方程式不正确的是( )A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2
下列离子方程式不正确的是()A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-沉淀
氰(CN)2 硫氰(SCN)2的化学性质和卤素很相似 化学上称为“类卤素” 它们阴离子的还原性强弱为
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.试写出:(1)(CN
下列离子方程式中正确的是( )A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH-
下列离子方程式中正确的是()A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH- + H2 ↑B.氯气通入水中C.FeBr2溶液中加入过量的新制氯水 2Fe2++4B
能用来表示的化学反应是A.氢氧化铁和稀盐酸反应B.氨水和稀硫酸反应C.氢氧化钠溶液和稀硝酸反应D.二
能用来表示的化学反应是A.氢氧化铁和稀盐酸反应B.氨水和稀硫酸反应C.氢氧化钠溶液和稀硝酸反应D.二氧化碳通入澄清石灰水












