(9分)生产生活中广泛涉及氧化还原反应。(1)工业上冶炼下列物质通常不采用电解法的是
| (9分)生产生活中广泛涉及氧化还原反应。 (1)工业上冶炼下列物质通常不采用电解法的是 。 a.Na b.Mg c.Fe d.Ag (2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。 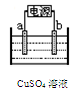 (3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。 (4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。 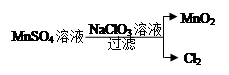 |
参考解答
| (1)cd (2分) (2)正(1分) Cu2++2e ̄='Cu' (1分) (3)KNO3 N2 1:5 (共3分,各1分) (4)5Mn2+ + 2ClO3 ̄ + 4H2O = 5MnO2↓+ Cl2↑+ 8H+ (2分) |
试题分析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。 (2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e ̄=Cu。 (3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5. (4)根据图示可知,ClO3 ̄把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3 ̄ + 4H2O = 5MnO2↓+ Cl2↑+ 8H+ |
相似问题
下列离子方程式中 正确的是( )A.稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ B
下列离子方程式中,正确的是()A.稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ B.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++AgC.碳酸氢钠溶液与稀盐酸混合:HCO
多原子分子氰(CN)2 硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2 Br2等)相似 故称
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)
下列反应的离子方程式书写正确的是A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=Ba
下列反应的离子方程式书写正确的是A.硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2OB.Fe(OH)3胶体的制备:Fe3++3H2OFe(OH)3↓+3H+C.向明矾溶
下列各组中两种物质在溶液里的反应 可用同一离子方程式表示的是A.KCl+AgNO3;AlCl3+ A
下列各组中两种物质在溶液里的反应,可用同一离子方程式表示的是A.KCl+AgNO3;AlCl3+ AgNO3B.NaHCO3+H2SO4;Na2CO3+HClC.NaHCO3+NaOH;Ca(HCO3)+KOHD.BaCl2+H2SO4;Ba(OH)2+H2SO4
下列热化学方程式或离子方程式中 正确的是:A.甲烷的标准燃烧热为-890.3kJ·mol-1 则甲烷
下列热化学方程式或离子方程式中,正确的是:A.甲烷的标准燃烧热为-890 3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)












