现有含NH4+ H+ Al3+ Mg2+ Cl-的溶液100mL 往其中逐滴加入2mol/L的氢氧化
现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如下图,其中OA段无气体产生,回答下列问题。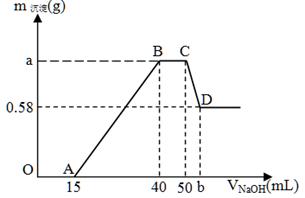 (1)写出下列过程发生反应的离子方程式。 OA段: ; CD段: ; (2)氢氧化镁沉淀的质量m[Mg(OH)2] = g。 (3)a = ;b = 。 (4)原溶液中c(NH4+) = ;c(Cl-) = 。 |
参考解答
| (16分) (1)H+ + OH- = H2O(3分);Al(OH)3 + OH- = [Al(OH)4-(3分) (2)0.58(2分) (3)1.36(2分);55(2分) (4)0.2mol/L(2分);1mol/L(2分) |
试题分析:(1)OA段无气体产生,说明是H+和OH-的反应,离子方程式为H+ + OH- = H2O。 CD段是沉淀溶解的过程,Al(OH)3是和OH-反应,离子方程式为Al(OH)3 + OH- = [Al(OH)4-。 (2)最终沉淀的物质是氢氧化镁沉淀,根据图中信息可得其质量等于0.58g。 (3)V(NaOH)=25mL,n(NaOH)=0.05mol,AB段,生成的沉淀是Al(OH)3和Mg(OH)2,m[Mg(OH)2 =0.58g,Mg(OH)2中的n(OH-)=0.02mol,则Al(OH)3中的n(OH-)=0.05mol-0.02mol=0.03mol,即m[Al(OH)3=0.78g,故总质量=0.58g+0.78g=1.36g,即a=1.36g。Al(OH)3 + OH- = [Al(OH)4-,n[Al(OH)3=0.01mol,消耗NaOH为0.01mol,体积为0.005L,即5ml,故b=50+5=55。 (4)BC段NH4+和OH-的反应,反应的n(OH-)=0.02mol,NH4++OH-=NH3·H2O,n(NH4+)=0.02mol,c(NH4+) =0.2mol/L。当 V(NaOH)=50mL时溶质为NaCl,n(Cl-)= n(Na+)=0.1mol,即c(Cl-) =1mol/L。 点评:本题考查学生利用图象及离子反应来计算,明确图象中每一段曲线对应的化学反应是解答本题的关键,然后利用离子反应计算即可解答,B项是解答的难点。 |
相似问题
下列离子方程式书写正确的是A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-='==
下列离子方程式书写正确的是A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-="==" CaCO3↓+CO32-+2H2OB.向KI与稀硫酸的混合溶液中通入氧气
下列反应的离子方程式正确的是A.向稀氨水中加入稀盐酸 OH- + H+ =H2OB.硫化亚铁溶于稀硝
下列反应的离子方程式正确的是A.向稀氨水中加入稀盐酸 OH- + H+ =H2OB.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑C.碳酸钙溶于醋酸中 CaCO3 +
下列表示对应化学反应的离子方程式正确的是A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=C
下列表示对应化学反应的离子方程式正确的是A.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑B.硫酸氢铵溶液中加入少量氢氧化钠溶液:NH
离子反应方程式能表示物质在溶液中进行离子反应的实质。下列反应的离子方程式的书写中 正确的是 A.硫酸
离子反应方程式能表示物质在溶液中进行离子反应的实质。下列反应的离子方程式的书写中,正确的是 A.硫酸溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO
下列离子方程式书写正确的是( )A.钠与硫酸铜溶液反应:B铁屑溶于过量稀硝酸:C.石灰石溶于醋酸
下列离子方程式书写正确的是()A.钠与硫酸铜溶液反应:B铁屑溶于过量稀硝酸:C.石灰石溶于醋酸:D.FeI2溶液中通人少量氯气:












