二氧化氯(ClO2)为一种黄绿色气体 是国际上公认的高效 广谱 快速 安全的杀菌消毒剂。(1)工业上
| 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。 (1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。 ①浓盐酸在反应中显示出来的性质是________。
(2)目前已开发出用电解法制取ClO2的新工艺。 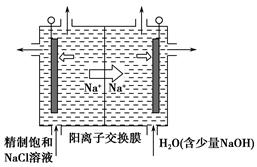 ①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为_____________________________________。 ②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。 (3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m3这种污水,至少需要ClO2________mol。 |
参考解答
| (1)①B ②0.1 (2)①Cl--5e-+2H2O=ClO2↑+4H+ ②0.01 在阴极上发生反应2H++2e-=H2↑,H+浓度减小,使得H2O OH-+H+的平衡向右移动,OH-浓度增大,pH增大 (3)2ClO2+2CN-=N2↑+2CO2↑+2Cl- 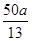 |
①电解饱和食盐水制取ClO2,ClO2为氧化产物,故应在阳极产生,Cl-失去5个电子生成ClO2,而ClO2中含有氧元素,故还有H2O参加反应,再根据质量守恒配平电极反应式即可。②阴极产生标准状况下112 mL H2,转移电子0.01 mol,消耗的n(H+)=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na+通过阳离子交换膜移向阴极。阴极上H2O电离出的H+放电,导致H2O的电离平衡向右移动,OH-浓度增大,溶液pH增大。(3)处理污水时生成的两种气体不能具有污染性,应为CO2和N2,再根据得失电子守恒和原子守恒配平即可。由离子反应方程式可知消耗的ClO2的物质的量等于污水中CN-的物质的量,即n(ClO2)=n(CN-)=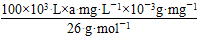 = =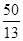 amol。 amol。 |
相似问题
下列反应中 属于氧化还原反应的是[ ]A.Fe(OH)3 + 3HNO3 == Fe(NO3
下列反应中,属于氧化还原反应的是[ ]A.Fe(OH)3 + 3HNO3 == Fe(NO3)3 + 3H2OB.3Cu+8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+4H2OC.3NH3·H2O + AlCl3 = Al(OH)3↓+3NH4Cl D.CH3COOH +NaOH = CH3COONa + H2O
下列有关氧化还原反应的叙述中正确的是 [ ]A.有单质参加或有单质生成的反应一定是氧化还原反
下列有关氧化还原反应的叙述中正确的是 []A.有单质参加或有单质生成的反应一定是氧化还原反应 B.氧化还原的本质是元素化合价的升降 C.失电子的反应
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中 逐滴加入浓度为0
在1 L含0 1 mol NaAlO2和0 1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0 1 mol·L-1H2SO4溶液,下列图像中能表示反应产生沉淀的物质的量与加入硫
油炸虾条 薯片等容易挤碎的食品 不宜选用真空袋装 而应采用充气袋装。下列气体最不应该充入的是[
油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体最不应该充入的是[ ]A.氮气B.二氧化碳 C.空气 D.氧气
下列说法可以实现的是[ ]①酸性氧化物均能与碱发生反应②弱酸溶液与强酸盐溶液反应可以生成强酸
下列说法可以实现的是[ ]①酸性氧化物均能与碱发生反应②弱酸溶液与强酸盐溶液反应可以生成强酸③发生复分解反应,但产物既没有水生成,也没有沉淀和气












