二氧化硫和氮氧化物(NOx)对大气污染日趋严重 研究消除大气污染的方法是化学工作者的重要课题 目前有
| 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。 (1)可利用甲烷催化还原NOx的方法处理NOx,反应如下: CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1 CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1 则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H= ; (2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) 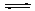 N2(g)+2CO2(g);△H<0。 N2(g)+2CO2(g);△H<0。若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位); 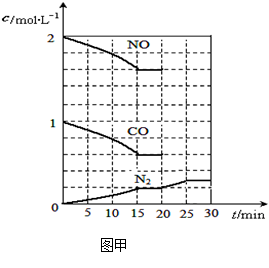 ①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”); ②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”); ③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填字母);
|
参考解答
| (1)△H=-867 kJ·mol–1 (3分) (2)K=0.035(或带单位:L/mol)(3分);向右、不移动; B(各2分) (3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(3分) |
试题分析:(1) ①CH4(g) + 4NO2(g) =' 4NO(g)' + CO2(g) + 2H2O(g) △H=' –574' kJ·mol–1; ②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H=' –' 1160 kJ·mol–1; 依据盖斯定律计算①+ ②得到:CH4(g) + 2NO2(g) = N2(g) + CO2(g) + 2H2O(g) △H=' –867' kJ·mol–1; 故答案为:△H= –867 kJ·mol–1; (2)依据图象分析,15min时达到平衡时N2浓度为0.2mol·L–1,NO平衡浓度为1.6mol·L–1,CO浓度为0.6 mol·L–1,CO2浓度为0.4 mol·L–1,反应2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的平衡常数 N2(g) + 2CO2(g)的平衡常数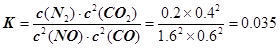 。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) =' 1.2' mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)='1.6' mol·L–1,c(CO)='0.6' mol·L–1 + 0.6 mol·L–1 =' 1.2' mol·L–1,c(N2) =' 0.2' mol·L–1 + 0.6 mol·L–1 =' 0.8' mol·L–1,c(CO2) =' 0.4' mol·L–1; 。故答案为:0.035。①若保持温度不变,20min时再向容器中充入CO气体0.6mol,此时c(CO) =' 1.2' mol·L–1,而生成物浓度不变,根据平衡移动原理,平衡将正反应方向移动。②若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)='1.6' mol·L–1,c(CO)='0.6' mol·L–1 + 0.6 mol·L–1 =' 1.2' mol·L–1,c(N2) =' 0.2' mol·L–1 + 0.6 mol·L–1 =' 0.8' mol·L–1,c(CO2) =' 0.4' mol·L–1;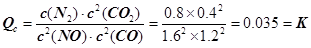 ,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。 ,平衡不动。③如图甲所示,20min时,改变反应条件,导致反应速率减小,氮气浓度增大,平衡正向移动。加入催化剂,平衡不移动,A不合题;反应是气体体积减小的放热反应,降温可使平衡正向移动,氮气浓度增大,B符合题意;缩小容器体积虽然可使平衡正向移动,但改变条件的瞬间,N2浓度增大,与图中描绘的情况不符,C不合题意;增加CO2的量,平衡逆向移动,N2浓度减小,D也不合题。故答案为:B。(3) 总反应的离子方程式为:2SO2+O2+2H2O=4H+ + 2SO42-,总反应减去反应4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O即得另一离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。 |
相似问题
下列离子方程式书写正确的是A.实验室用氯化铁溶液制取氢氧化铁胶体:Fe3++3H2OFe(OH)3(
下列离子方程式书写正确的是A.实验室用氯化铁溶液制取氢氧化铁胶体:Fe3++3H2OFe(OH)3(胶体)+3H+B.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑C.
下列离子方程式正确的是( )A.碳酸钙溶于醋酸:CaCO3+2H+= Ca2++CO2↑ +H
下列离子方程式正确的是( )A.碳酸钙溶于醋酸:CaCO3+2H+= Ca2++CO2↑ +H2OB.Fe3O4溶于稀盐酸:Fe3O4+8H+=3Fe3++4H2OC.用烧碱溶液吸收氯气:Cl2+2OH
能正确表示下列反应的离子方程式是A.向0.1mol/L的Na2S溶液中加入B.碳酸钠溶液显碱性的原因
能正确表示下列反应的离子方程式是A.向0 1mol L的Na2S溶液中加入B.碳酸钠溶液显碱性的原因:C.二氧化硫通入氯化铁溶液:D.用醋酸清洗盛放石灰水试剂
下表对某些反应方程式的评价合理的是( )编号实验离子方程式或电极反应式评价A次氯酸钙溶液中通入足量
下表对某些反应方程式的评价合理的是( )编号实验离子方程式或电极反应式评价A次氯酸钙溶液中通入足量SO2Ca2++ClO-+SO2+H2OCaSO4↓+Cl-+2H+正确BBa(OH)
下列化学反应的离子方程式正确的是( )A.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2
下列化学反应的离子方程式正确的是( )A.向稀盐酸溶液中加铁:3Fe+6H+=3Fe3++3H2↑B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-C.向氯化铝溶液中加入












