A B C D E是五种原子序数依次增大的短周期元素 B是地壳中含量最多的元素.已知A C及B E分
| A、B、C、D、E是五种原子序数依次增大的短周期元素,B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素. (1)A、B、C形成的化合物的电子式为______; (2)一点温度下,浓度相同的B、C、D组成的化合物的水溶液与A、C、E组成的化合物的水溶液的pH______>______(填化学式) (3)D与C元素最高价氧化物对应水化物反应的离子方程式______ (4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式______ (5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,电池的负极通入的是______气体,电极反应式______; (6)通常条件下,C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6kJ,试写出表示该热量变化的离子方程式______. |
参考解答
(1)A为H,B为O,C为Na,D为Al,E为S,A、B、C形成的化合物为氢氧化钠,电子式为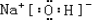 ,故答案为: 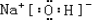 ; (2)B、C、D组成的化合物为NaAlO2,A、C、E组成的化合物为NaHS,氢氧化铝为两性氢氧化物,硫化氢为弱酸,故酸性硫化氢大于氢氧化铝,故浓度相同两种混合物水解时,碱性NaAlO2>NaHS,故答案为:NaAlO2>NaHS; (3)C元素最高价氧化物对应水化物为氢氧化钠,D为Al,故反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑, 故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑; (4)A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体,可以为硫酸氢钠与亚硫酸氢钠的反应,离子方程式如下H++HSO3-=SO2↑+H2O, 故答案为:H++HSO3-=SO2↑+H2O; (5)氢气和氧气组成的燃料电池,负极为氢气,电极反应为H2+2OH--2e-=2H2O,故答案为:氢气;H2+2OH--2e-=2H2O; (6)C的最高价氧化物对应水化物为氢氧化钠2mol与E最高价氧化物对应水化物硫酸1mol的稀溶液,反应的实质为氢离子和氢氧根离子反应,故热化学方程式为H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,故答案为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol. |
相似问题
下列离子方程式正确的是( )A.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2+
下列离子方程式正确的是( )A.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2OB.钠与水反应:Na+2H2O=Na++2OH-+H2↑C.
下列反应的离子方程式正确的是( )A.碳酸镁溶于硝酸中:CO32-+2H+═H2O+CO2↑B.A
下列反应的离子方程式正确的是( )A.碳酸镁溶于硝酸中:CO32-+2H+═H2O+CO2↑B.AlCl3水解反应:Al3++3H2O═Al(OH)3↓+3H+C.向稀氨水中加入稀盐
写出CuSO4溶液和BaCl2溶液反应的离子方程式______ 发生了该反应的实验现象是______
写出CuSO4溶液和BaCl2溶液反应的离子方程式______,发生了该反应的实验现象是______.为了检验某些离子实际上没有参加反应,还要进行的实验是(简要地写
下列离子方程式正确的是( )A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑B.氧化镁与盐酸混
下列离子方程式正确的是( )A.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑B.氧化镁与盐酸混合:MgO+2H+═Mg2++2H2OC.铜片插入硝酸银溶液中:Cu+Ag+═Cu2
下列各组物质间反应可能包括多步反应 其总的离子方程式正确的是( )A.在硫酸工艺流程中 对尾气中的
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应2NH3?H2O+SO2=2NH4++












