工业生产纯碱的工艺流程示意图如下:完成下列填空:(1)粗盐水加入沉淀剂A B除杂质(沉淀剂A来源于石
工业生产纯碱的工艺流程示意图如下: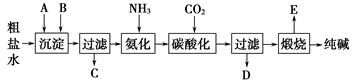 完成下列填空: (1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。 A______________ B____________。 (2)实验室提纯粗盐的实验操作依次为: 取样、__________、沉淀、__________、__________、冷却结晶、__________、烘干。 (3)工业生产纯碱工艺流程中,碳酸化时产生的现象是__________________。 碳酸化时没有析出碳酸钠晶体,其原因是______________________. (4)碳酸化后过滤,滤液D最主要的成分是______________(填写化学式),检验这一成分的阴离子的具体方法是:______________________。 (5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:____________________________。 (6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:__________(注明你的表达式中所用的有关符号的含义)。 |
参考解答
| (1)Ca(OH)2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤 (3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大 (4)NH4Cl 取少量试样,加硝酸酸化,加硝酸银溶液有白色沉淀,该阴离子是氯离子 (5)NH4++OH-  NH3↑+H2O NH3↑+H2O(6)w(NaHCO3)= 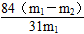 (m1表示反应前样品质量,m2表示加热后固体的质量) (m1表示反应前样品质量,m2表示加热后固体的质量) |
| (1)根据沉淀剂A的来源,可知A可能是CaO或Ca(OH)2。B的作用是用来除去加入过量的沉淀剂,为不引入新的杂质则选用Na2CO3。 (2)考查考生对粗盐提纯的基本技能操作:取样→溶解→沉淀→过滤→蒸发→冷却→结晶→过滤→烘干。 (3)氨化后的氯化钠溶液中通入CO2酸化,因在氨的作用下会产生碳酸氢钠:NaCl+NH3·H2O+CO2=NaHCO3↓+NH4Cl,由于NaHCO3的溶解度较小,从溶液中析出。 (4)滤液中含有NH4Cl,Cl-的检验通常是用HNO3酸化的AgNO3溶液,若能产生白色沉淀,即可证明Cl-的存在。 (5)离子方程式是NH4+  NH3↑+H2O。 NH3↑+H2O。(6)设样品质量为m1,加热后固体质量为m2。 2NaHCO3  Na2CO3+CO2↑+H2O Δm Na2CO3+CO2↑+H2O Δm168 62 x m1-m2 x= 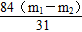 则NaHCO3的质量分数为:ω(NaHCO3)= 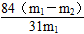 。 。 |
相似问题
保存金属钠的方法是[ ]A.放在棕色瓶中 B.放在CCl4中C.放在水中D.放在煤油中
保存金属钠的方法是[ ]A.放在棕色瓶中 B.放在CCl4中C.放在水中D.放在煤油中
等质量的钠进行下列实验 其中生成氢气最多的是[ ]A.将钠投入足量的水中B.将钠用铝箔包好并
等质量的钠进行下列实验,其中生成氢气最多的是[ ]A.将钠投入足量的水中B.将钠用铝箔包好并刺一些小孔,再放入足量的水中C.将钠投入足量的稀硫酸中D
等质量的钠进行下列实验 其中生成氢气最多的是[ ]A.将钠投入足量的水中B.将钠用铝箔包好并
等质量的钠进行下列实验,其中生成氢气最多的是[ ]A.将钠投入足量的水中B.将钠用铝箔包好并刺一些小孔,再放入足量的水中 C.将钠投入足量的稀硫酸中
A B C D是按原子序数由小到大排列的第二 三周期元素的单质。B E均为组成空气的成分。F的焰色反
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比
某些资料认为:NO NO2不能与Na2O2反应。某小组学生提出质疑 他们从理论上分析过氧化钠和二氧化
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:假设Ⅰ.过












