某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。(1)称取两种固体各2 g
| 某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。 (1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。 ① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。 ② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。 A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色 (2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。 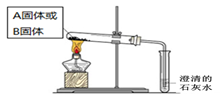 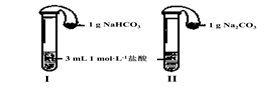 (3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。 两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。 ② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。 A.装置I的气球体积较大 B.装置II的气球体积较大 C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算 (4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
请写出上述实验过程中发生的反应的离子方程式: 实验1: ;实验2: 。 |
参考解答
| (1)①同温度下,Na2CO3比NaHCO3易溶于水(2分,不说明温度条件的扣1分) ②B、D(2分) (2)Ca(OH)2+CO2=CaCO3↓+H2O(2分) CaCO3+CO2+H2O=Ca(HCO3)2(2分) (3)①Ⅰ(2分) (2)A、C(2分,少选1个得1分,错选、不选不得分) (4)实验1:Ca2++CO32-=CaCO3↓(2分) 实验2:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O(2分) |
试题分析: (1)本题探究的Na2CO3和NaHCO3两种物质都是我们中学阶段非常熟知的两种钠盐,这两种物质进行对比,很多性质可以直接结合我们所学内容得出。此处称取等量的两种物质溶解,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在相同温度下Na2CO3固体的溶解度要大于NaHCO3固体。这两种钠盐溶解均是放热的,所以会使体系温度升高。同时它们均是强碱弱酸盐,水解呈碱性使酚酞变红。故选BD。 (2)NaHCO3 受热易分解产生CO2,使澄清石灰水变浑浊,但是通了一段时间的CO2后,产生的沉淀CaCO3又与过量的CO2反应生成了可溶的Ca(HCO3)2,所以溶液又变澄清。整个过程发生的反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O 、 CaCO3+CO2+H2O=Ca(HCO3)2 。 (3)①②Na2CO3和NaHCO3两种物质均能与HCl反应产生CO2气体,但是反应中CO32- 要先与H+反应生成HCO3-,然后再由HCO3-与H+反应生成CO2,经过2个步骤,所以装置I反应要慢,装置II要跟更为剧烈。 ②所得气球的体积大小主要看反应生成的CO2气体的体积,根据C原子守恒,1g的Na2CO3和1g NaHCO3 中,NaHCO3 能生成的CO2物质的量大,所以产生的气体多,故A正确;此实验中盐酸均完全反应,所以气体体积根据盐酸来计算,故C正确;故选AC。 (4)实验1中产生白色沉淀是由于钙离子和碳酸根离子结合生成了碳酸钙沉淀,所以离子方程式为: Ca2++CO32-=CaCO3↓;而实验2中理论上HCO3-与Ca2+ 不能反应,没有沉淀生成,但是由实际结果推测HCO3-发生微弱电离产生CO32-和H+,电离产生的CO32-与Ca2+ 结合生成了碳酸钙沉淀,同时进一步促进了电离,使得电离产生的H+又与溶液中的HCO3-反应生成CO2气体,所以离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O。 |
相似问题
在烧杯中加入水和苯各50 mL 将一小块金属钠投入烧杯中。你可能观察到的现象[ ]A.钠与水
在烧杯中加入水和苯各50 mL,将一小块金属钠投入烧杯中。你可能观察到的现象[ ]A.钠与水剧烈反应,反应产生的热量导致苯燃烧 B.钠在水层中反应并四
下列现象或性质能体现钠的物理性质的是①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④
下列现象或性质能体现钠的物理性质的是①钠燃烧时发出黄色的火焰 ②钠燃烧时生成过氧化钠 ③熔点低 ④密度比水⑤热和电的良导体 ⑥钠有很强的还原
有A B两种常见化合物组成的混合物 其焰色反应均为黄色 其相互转化关系如图(其他物质均略去)。根据以
有A、B两种常见化合物组成的混合物,其焰色反应均为黄色,其相互转化关系如图(其他物质均略去)。根据以上关系,回答下列问题:(1)写出A、B、C、D的化学式
下列说法中正确的是 [ ]① 钠在空气中燃烧生成淡黄色的Na2O2 ② 常温下铝制容器可储
下列说法中正确的是 [ ]①钠在空气中燃烧生成淡黄色的Na2O2 ②常温下铝制容器可储运浓硫酸或浓硝酸 ③盐酸既有氧化性又有还原性 ④Fe(OH)3、FeCl2、
在讲授在空气中的反应时 老师将一块银白色的金属钠放在空气中 学生观察到发生一系列的变化:表面迅速变暗
在讲授在空气中的反应时,老师将一块银白色的金属钠放在空气中,学生观察到发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙












