现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物 取其1.896g加热至质量不再变化 把放
| 现有一种碱金属的碳酸盐(M2CO3)和碳酸氢钠组成的混合物,取其1.896g加热至质量不再变化,把放出的气体通入足量的澄清石灰水中,得到白色沉淀0.800g。将加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.336 g。 (1)试通过计算确定M2CO3的M为何种元素。 (2)有同学提出,通过简单的定性实验,也可以确定该样品中的M为何种碱金属元素。你认为该实验方案是什么? |
参考解答
| (1)(3分) 2NaHCO3~ Na2CO3 ~ CO2~ CaCO3 n(NaHCO3)= 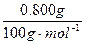 × 2=0.016mol × 2=0.016mol2CO2+2Na2O2=2Na2CO3+O2 △m 2mol 56g (0.012mol) 0.336g 加热后的n(M2CO3)=0.012mol- 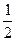 ×0.016mol =0.004mol 设M的相对原子质量分别x。 ×0.016mol =0.004mol 设M的相对原子质量分别x。依题意:84g·mol-1×0.016mol+(2x+60)g·mol-1×0.004mol=1.896g x=39 根据碱金属的相对原子质量,可知M元素是K。 (2)对混合物进行焰色反应实验,透过蓝色的钴玻璃,若看到浅紫色火焰,则说明M元素是K。(2分) |
| 略 |
相似问题
下列关于钠的叙述中 不正确的是( )A.钠燃烧时发出黄色的火焰 生成过氧化钠B.钠应保存在煤油中C.
下列关于钠的叙述中,不正确的是()A.钠燃烧时发出黄色的火焰,生成过氧化钠B.钠应保存在煤油中C.钠有很强的还原性D.金属钠着火时,可以用水灭火
下列说法中正确的是( )A.Na2O2是碱性氧化物 溶于水生成相应的碱B.金属钠应保存在磨口玻璃
下列说法中正确的是()A.Na2O2是碱性氧化物,溶于水生成相应的碱B.金属钠应保存在磨口玻璃瓶中C.金属钠在常温时和氧气反应生成氧化钠D.固体NaOH暴露
某固体混合物可能含有下列物质Na2O2 Na2CO3 NaHCO3 NaCl 向混合物中加入足量的盐
某固体混合物可能含有下列物质Na2O2、Na2CO3、NaHCO3、NaCl,向混合物中加入足量的盐酸,有气体放出,将放出的气体通入足量的NaOH溶液后,气体体积减少了
已知和的混合物与反应时是与反应完后 再与反应.现将a mol的和固体混合后 在密闭容器中加热到250
已知和的混合物与反应时是与反应完后,再与反应.现将a mol的和固体混合后,在密闭容器中加热到250℃,让其充分反应, (1)当剩余固体为,排出气体
(3分)金属钠与其在空气中燃烧产物x分别加入到足量水中 生成的两种气体在一定条件下恰好完全反应 则与
(3分)金属钠与其在空气中燃烧产物x分别加入到足量水中,生成的两种气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成x的金属钠的质量比。












