分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测
| 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题. (1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式______. (2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是______; (3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g?℃).为了计算中和热,实验时还需测量的数据有(填序号)______. A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量 C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量 E.反应后混合溶液的最高温度 F.反应后混合溶液的质量 (4)某学生实验记录数据如下:
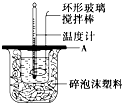 | |||||||||||||||||||
参考解答
(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:NaOH(aq)+
故答案为:NaOH(aq)+
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,若两个小孔开得过大,会导致散失较多的热量,影响测定结果, 故答案为:减少热量散失; (3)由Q=cm△T可知,测定中和热需要测定的数据为:A.反应前盐酸溶液的温度、B.反应前盐酸溶液的质量和E.反应后混合溶液的最高温度, 故选ACE; (4)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃; 第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应前后温度差为:3.1℃; 第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应前后温度差为:3.05℃; 40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液的质量和为m=80mL×1g/cm3=80g,c=4.18J/(g?℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g?℃)×80g×
故答案为:-51.8kJ/mol. |
相似问题
有A B C三瓶失去标签的无色溶液:K2CO3 BaCl2 Na2SO4。将它们分别与H2SO4作用
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。将它们分别与H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。则A是________,B是________, C是________。
有a b c d e五种气体 进行下列实验a b c d e依次可能是[ ]A.O2 NO
有a、b、c、d、e五种气体,进行下列实验a、b、c、d、e依次可能是[ ]A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3 C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
区别二氧化硫和二氧化碳气体的最佳方法是[ ]A.通入澄清石灰水B.用湿润的蓝色石蕊试纸C.用
区别二氧化硫和二氧化碳气体的最佳方法是[ ]A.通入澄清石灰水B.用湿润的蓝色石蕊试纸C.用品红溶液 D.根据有无毒性
a b c d是HCl BaCl2 AgNO3 Na2CO3四种溶液中的一种 现将它们两两混合 现象
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:由上述现象可推知a、b、c、d依次是 [ ]A.HCl、BaCl2、A
北京2008奥运会金牌直径为70 mm 厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由
北京2008奥运会金牌直径为70 mm,厚6 mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造,乙认为金牌是由金银合金制成;丙认为金牌是由黄












