(11分)(1)一定温度下 在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)
(11分)(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g) 列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0 4NO2(g)+O2(g) ;⊿H>0①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、 “减小”或“不变”)。 ②下表为反应在T1温度下的部分实验数据:
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2 T1。(填“>”、“<” 或 “ =”) (2)如图所示装置可用于制备N2O5,则N2O5在电解池的 区 (填“阳极”或“阴极”)生成,其电极反应式为 。 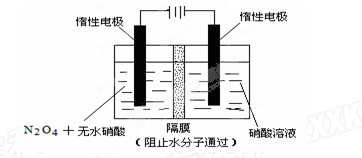 |
参考解答
| 1)不变 2分 0.00296 mol·L—1·s—1 2分 <或小于 2分 (2)阳极2分 N2O4+2HNO3—2e—=2N2O5+2H+ 3分 |
| 略 |
相似问题
(10分)将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中 进行如下反应:2 H
(10分)将6 mol H2和3 mol CO充入容积为0 5 L的密闭容器中,进行如下反应:2 H2(气) + CO(气) CH3OH(气),6秒时体系达到平衡,此时容器内气体
密闭容器中的可逆反应3A(g)3 B+C ΔH='+890' kJ/mol(A的式量为120)随
密闭容器中的可逆反应3A(g)3 B+C ΔH="+890" kJ mol(A的式量为120)随着温度升高,容器中气体相对平均分子质量减小,则下列判断正确的是( ).A
对于可逆反应:下面图像对于平衡体系 mA(g)+nB (g) pC(g)+qD (g) DH
对于可逆反应:下面图像对于平衡体系,mA(g)+nB (g) pC(g)+qD (g)DH <0有下列判断,其中正确的是()A.若温度不变,将容器的体积扩大1倍,此时A的浓
在相同温度和体积均为1L的四个密闭容器中 保持温度和容积不变 以四种不同的投料进行反应。平衡时有关数
在相同温度和体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料进行反应。平衡时有关数据如下(已知相同条件下:2SO2+O22SO3△H =-196
在恒温恒容条件下 将4molA和2molB放入一密闭容器中2A(g)+B(g)2C(g)+D(s)
在恒温恒容条件下,将4molA和2molB放入一密闭容器中2A(g)+B(g)2C(g)+D(s),达到平衡时,C的体积分数为a;在相同条件下,按下列配比分别投放A、B、C、D,


 00
00









