工业废水中常含有一定量的Cr2O72-和CrO42- 它们会对人类及生态系统产生很大损害 必须进行处
| 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。 方法1:还原沉淀法 该法的工艺流程为:CrO42- 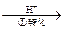 Cr2O72- Cr2O72-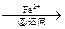 Cr3+ Cr3+ Cr(OH)3↓ Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+  Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O⑴若平衡体系的pH=2,该溶液显 色。 ⑵能说明第①步反应达平衡状态的是  。 。a. Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变 ⑶第②步中,还原1molCr2O72-离子,需要 mol的FeSO4  7H2O。 7H2O。方法2:电解法 该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。 ⑷用Fe做电极的原因为 。 ⑸在阴极附近溶液pH升高的原因是(用电极反应解释) ,溶液中同时生成的沉淀还有 。 ⑹写出Cr2O72--变为Cr3+的离子方程式___________________; |
参考解答
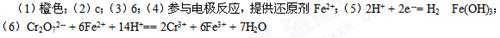 |
| 略 |
相似问题
(15分)在密闭容器中将NO2加热到某温度时 进行如下的反应:2NO22NO+O2 反应5分钟后达平
(15分)在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO22NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0 06 mol L,c(NO
某一反应在一定条件下的平衡转化率为25.3% 当使用了催化剂时 其转化率为( )A.大于25.3
某一反应在一定条件下的平衡转化率为25 3%,当使用了催化剂时,其转化率为()A.大于25 3%B.小于25 3%C.等于25 3%D.约等于25 3%
在容积恒定的密闭容器中 存在下列平衡:2HBr(g)H2(g)+Br2(g)-Q 若升高温度 发生改
在容积恒定的密闭容器中,存在下列平衡:2HBr(g)H2(g)+Br2(g)-Q,若升高温度,发生改变的是()A.分子数B.压强C.密度D.平均摩尔质量
(每空2分共8分)向体积不变的密闭容器中充入2 mol N2和6 mol H2 一定条件下发生反应:
(每空2分共8分)向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:N2(g)+ 3 H2(g)2 NH3(g),平衡时混合气体共7 mol.
(12分)某可逆反应的平衡常数表达式 恒容时 温度升高H2浓度减小。试回答下列问题:(1)该反应的化
(12分)某可逆反应的平衡常数表达式,恒容时,温度升高H2浓度减小。试回答下列问题:(1)该反应的化学方程式为:。(2)温度升高,该反应的K值________












