(15分)氨是最重要的氮肥 是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法 是德国人哈伯在
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: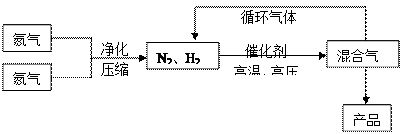
反应体系中各组分的部分性质见上表: (1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。 (2)工业上采取用上述  (1)操作的目的: (1)操作的目的: 。 (3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。 (4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g)  2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是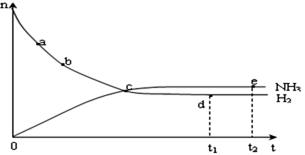 A.点a的正反应速率比点b的大 B.点 c处反应达到平衡 C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大 |
参考解答
 |
| 略 |
相似问题
对于可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)下列叙述正确的是( )。A.
对于可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)下列叙述正确的是( )。A.达到平衡时:4v正(O2)=5v逆(NO)B.若单位时间内生成x mol NO的同时
(12分)在一定条件下 存在如下反应:2SO2(g)+ O2 (g) 2SO3(g);ΔH
(12分)在一定条件下,存在如下反应:2SO2(g)+ O2 (g) 2SO3(g);ΔH<0(1)写出该反应的化学平衡常数表达式K= (2)升高温度,该反应K值,SO2转化率,正
一定条件下 将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)SO3(g)+
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)SO3(g)+NO(g)的可逆反应,下列能说明反应达到平衡状态的是( )。A.体系压强保
一定条件下 在密闭容器中 能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生
密闭容器中进行如下反应:N2O4(g) 2NO2(g) 当测得N2O4转化率为33.3%时 混合气体
密闭容器中进行如下反应:N2O4(g) 2NO2(g),当测得N2O4转化率为33 3%时,混合气体平均式量是()A.46B.61 3C.76 7D. 69












