某同学为了检验家里购买的硫酸铵化肥是否合格 他称取27.5 g化肥样品与足量浓烧碱溶液加热 产生的氨
某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5 g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收。测得吸收氨气的溶液总质量m与反应时间t的变化如右下图所示。所涉及的反应为: (NH4)2SO4+2NaOH Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4 == (NH4)2SO4 。 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4 == (NH4)2SO4 。 |
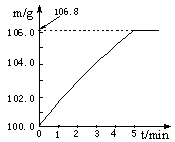 |
| 请计算: (1)完全反应后产生氨气 g。 (2)该化肥的含氮量为 (精确到0.1%),则这种化肥属于 (填:“合格”或“不合格”。合格硫酸铵含氮量为20%以上)产品。 (3)请计算废硫酸中硫酸的质量分数(写出计算过程)。 (4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。 |
参考解答
| 解:(1)6.8g (2)20.4%;合格 (3)解:设废硫酸中纯硫酸的质量为x 2NH3 + H2SO4 == (NH4)2SO4 34 98 6.8g x 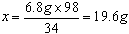 H2SO4质量分数=(19.6g÷100.0g)×100%=19.6% 答:废硫酸中硫酸的质量分数为19.6%。 (4)加热反应产生的水蒸汽被废硫酸吸收,导致所测吸收液质量比只吸收氨气大。 |
相似问题
根据氯元素化合价不同 有关物质按照一定的规律可排列为:①NaCl②Cl2③HClO④R⑤Cl2O7
根据氯元素化合价不同,有关物质按照一定的规律可排列为:①NaCl②Cl2③HClO④R⑤Cl2O7,则R可以是下列物质中的( )A.KClO3B.Ca(C1O)2C.HClO4D.HClO2
科学研究发现:金星大气的成分之一是三氧化二碳(C2O3) 实验证明三氧化二碳的化学性质与一氧化碳相似
科学研究发现:金星大气的成分之一是三氧化二碳(C2O3),实验证明三氧化二碳的化学性质与一氧化碳相似.下列关于三氧化二碳的说法中,不正确的是(
如图为某厂生产的“盖天力”补钙片标签上的部分文字 请仔细阅读后回答下列问题: 维生素D种类较多 其中
如图为某厂生产的“盖天力”补钙片标签上的部分文字,请仔细阅读后回答下列问题: 维生素D种类较多,其中维生素D2的化学式为C28H44O。试计算:(1)维生
实验室可用氯酸钾和二氧化锰制氧气 氯酸钾(KClO3)中氯元素的化合价为( )A.-5B.-1C.
实验室可用氯酸钾和二氧化锰制氧气,氯酸钾(KClO3)中氯元素的化合价为( )A.-5B.-1C.+5D.+7
测得Fe和Fe2O3的混合物中氧的质量分数为15% 则单质铁的质量分数为 [ ]A. 30%
测得Fe和Fe2O3的混合物中氧的质量分数为15%,则单质铁的质量分数为 [ ]A 30% B 50% C 70% D 85%












