已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜) Cu2(OH)2CO3(碱式碳酸铜)
| 已知某铜矿样品中主要成分是Cu2(OH)2CO3(碱式碳酸铜),Cu2(OH)2CO3(碱式碳酸铜)与稀盐酸反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.现称取22.2g该铜矿样品放入烧杯中,再加入稀盐酸充分反应,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示(假设铜矿中的杂质不与稀盐酸反应).请根据题意回答问题: (1)反应中生成CO2的质量为______. (2)该铜矿样品中Cu2(OH)2CO3的质量分数是多少? 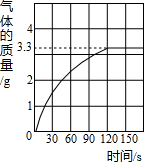 |
参考解答
| (1)根据曲线,反应放出二氧化碳的最大值为3.3g; 故答案为:3.3g(没单位不给分); (2)设铜矿样品中Cu2(OH)2CO3的质量为x Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O 222 44 x 3.3 g
x=16.65g Cu2(OH)2CO3的质量分数=
答:该铜矿样品中Cu2(OH)2CO3的质量分数是75%. |
相似问题
现有5.6g的生铁与足量的稀硫酸完全反应 产生氢气的质量是( )A.等于0.2gB.小于0.2gC
现有5 6g的生铁与足量的稀硫酸完全反应,产生氢气的质量是( )A.等于0 2gB.小于0 2gC.大于0 2gD.无法确定
硅是常温下化学性质稳定的半导体材料 广泛应用于计算机技术 光电池领域.某结晶硅厂用石英石(主要成分是
硅是常温下化学性质稳定的半导体材料,广泛应用于计算机技术、光电池领域.某结晶硅厂用石英石(主要成分是SiO2)和焦炭为原料生产粗硅(主要成分是Si)
常温下 下列各组物质分别置于密闭容器中 一定条件下充分反应 反应后 恢复到常温 在密闭容器中只有气态
常温下,下列各组物质分别置于密闭容器中,一定条件下充分反应,反应后,恢复到常温,在密闭容器中只有气态纯净物,这组物质是( )A.100g碳酸钙B.2
北京时间2011年11月1日 中国成功发射了神舟八号.飞船发射升空后与正在轨稳定运行的“天宫一号”目
北京时间2011年11月1日,中国成功发射了神舟八号.飞船发射升空后与正在轨稳定运行的“天宫一号”目标飞行器进行交会对接,为未来中国空间站的建立,奠定
世博会标志性建筑“东方之冠”的关键部位共使用了含铁2464吨的钢板 若这些钢板是通过一氧化碳还原氧化
世博会标志性建筑“东方之冠”的关键部位共使用了含铁2464吨的钢板,若这些钢板是通过一氧化碳还原氧化铁得到的,则至少需要氧化铁的质量为多少吨?(反












