某校课外活动小组的同学为测定黄铜(铜和锌的合金)中铜的质量分数 取20克黄铜于烧杯中 再将100克稀
| 某校课外活动小组的同学为测定黄铜(铜和锌的合金)中铜的质量分数,取20克黄铜于烧杯中,再将100克稀盐酸分加入装黄铜的烧杯中,恰好完全反应,反应后烧杯内物质的质量为119.8g。计算: (1)生成H2的质量。 (2)黄铜中铜的质量分数。 (3)反应后所得溶液中溶质的质量分数。 |
参考解答
| 解:(1)生成氢气的质量为:20g+100g-119.8g=0.2g 设黄铜中锌的质量为x,反应生成的ZnSO4质量为y。 Zn+H2SO4=ZnSO4+H2↑ 65 161 2 x y 0.2g 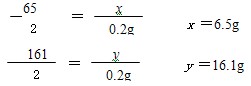 (2)黄铜中铜的质量分数为: 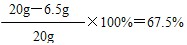 (3)反应后所得溶液中溶质的质量分数: 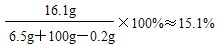 答:生成氢气的质量为0.2g;黄铜中铜的质量分数为67.5%;反应后所得溶液中溶质的质量分数约为15.1%。 |
相似问题
2011年中国空 且飞船与。标志着我国航天科学 叩开了空间站时代的大门。偏二甲肼( C2H8N2)
2011年中国空,且飞船与。标志着我国航天科学叩开了空间站时代的大门。偏二甲肼( C2H8N2)及四氧化二氮是火箭常用的燃料和氧化剂,秒内会燃烧2吨燃料,然
某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数 现称取该样品11g 加入到盛有50g稀盐酸
某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量
附加题已知Na2O2是一种淡黄色粉末 易与水反应 生成氢氧化钠和一种能使带火星的木条复燃的气体。现有
附加题已知Na2O2是一种淡黄色粉末,易与水反应,生成氢氧化钠和一种能使带火星的木条复燃的气体。现有Na2O与Na2O2的混合物1 09g和足量水反应后得到300g溶
实验室欲制取标准状况下的二氧化碳气体5.6L 需要含碳酸钙80%的大理石多少克?(已知标准状况下二氧
实验室欲制取标准状况下的二氧化碳气体5 6L,需要含碳酸钙80%的大理石多少克?(已知标准状况下二氧化碳的密度为1 98g L)
某校化学兴趣小组为测定某硝酸铵样品的纯度 将10g样品溶于30g水后 再加入13.7g氢氧化钠浓溶液
某校化学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入13 7g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应












