氯化钠的用途很多 工业上通过电解饱和食盐水的方法制取氢氧化钠 工业上以粗盐为原料制取氢氧化钠时 首先
氯化钠的用途很多,工业上通过电解饱和食盐水的方法制取氢氧化钠,工业上以粗盐为原料制取氢氧化钠时,首先要对粗盐进行精制,以除去粗盐中的MgCl2、CaCl2、MgSO4以及泥沙等杂质.某学习小组在实验室对粗盐进行精制,操作流程如下: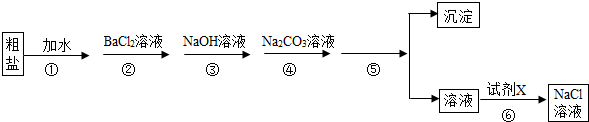 为了保证杂质能够完全除去,步骤②~④所加试剂都是稍过量,回答下列问题: (1)步骤⑤的操作名称是______. (2)步骤⑥加入的试剂X是______. (3)步骤③反应的化学方程式为______. (4)步骤④的目的是除去______. (5)步骤②与步骤④的顺序(填“可以”或“不可以”)______对调,若不可以,其原因是______(选择可以的,则此空不必填写). |
参考解答
| (1)过滤是将固体和液体进行分离的一种操作,经过操作⑤后分出了溶液和固体; (2)步骤⑥是为了除去过量的氢氧化钠和碳酸钠,加入盐酸,盐酸与氢氧化钠生成氯化钠和水,与碳酸钠生成氯化钠、二氧化碳和水; (3)加入氢氧化钠,可以除去溶液中的氯化镁,发生反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl; (4)步骤④加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,与氯化钙反应生成碳酸钙沉淀和氯化钠,所以步骤④的目的是除去过量的氯化钡和氯化钙; (5)步骤②和④不可以对调,因为若先加入碳酸钠溶液,后加入氯化钡溶液,过量的氯化钡不能除去,引入了新的杂质,影响产品质量,不符合除杂原则. 故答案为:(1)过滤; (2)盐酸; (3)MgCl2+2NaOH═Mg(OH)2↓+2NaCl; (4)BaCl2和CaCl2; (5)不可以,过量的BaCl2不能除去,影响产品的质量. |
相似问题
有两瓶无色液体 其中一瓶是蒸馏水 另一瓶是饱和食盐水 区别它们的方法有很多 请你简要写出尽可能多的你
有两瓶无色液体,其中一瓶是蒸馏水,另一瓶是饱和食盐水,区别它们的方法有很多,请你简要写出尽可能多的你认为可行的方法(至少写三种):(1)方法一:
某同学利用提供的以下实验用品 完成了氢气还原氧化铜的实验.实验用品:洁净的铜片 集气瓶(盛满H2)
某同学利用提供的以下实验用品,完成了氢气还原氧化铜的实验.实验用品:洁净的铜片、集气瓶(盛满H2)、酒精灯、火柴、坩埚钳(1)请简述其主要实验步骤
天原化工厂电解饱和食盐水前 先要除去粗盐中的Ca2+ Mg2+ SO42-及泥沙 可将粗盐溶于水 然
天原化工厂电解饱和食盐水前,先要除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作.其中正确的操作顺序是( )①过滤②
(1)粗盐中含有较多的不溶性杂质(泥沙等) 可通过______ ______ ______等操作进行
(1)粗盐中含有较多的不溶性杂质(泥沙等),可通过______、______、______等操作进行初步提纯.这三步操作中均用到一种常见仪器是______,它在各步中的
要除掉粗盐中含有的氯化镁 硫酸镁等杂质 现设计一个除杂质的方案:把粗盐溶于水 过滤得澄清溶液 再进行
要除掉粗盐中含有的氯化镁、硫酸镁等杂质,现设计一个除杂质的方案:把粗盐溶于水,过滤得澄清溶液,再进行下列各步骤处理:①加入氯化钡溶液至沉淀完全












