小明同学所在的学习小组对实验室用过氧化氢溶液制O2的知识做了全方位的探究 下面是他们的学习实录:(1
| 小明同学所在的学习小组对实验室用过氧化氢溶液制O2的知识做了全方位的探究,下面是他们的学习实录: (1)发生装置的探究: 根据反应物的状态和反应条件,小明从下列装置中选择了C作为发生装置,你认为他应该选择的收集装置是 或 。 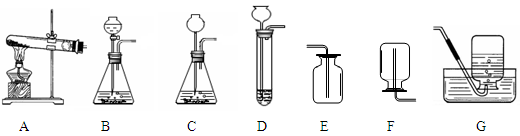 实验过程中小明发现,锥形瓶中产生了大量气泡,致使反应难以控制。该小组同学认为产生大量气泡是因为 。小聪建议将发生装置改成了B,其理由是 。 (2)催化剂选择的探究: 通过课堂上的学习,小平了解到:MnO2、土豆块都可以做为H2O2分解的催化剂,于是萌生了寻找适合催化剂的想法。通过查阅资料,小平还了解到CuCl2、CuSO4等盐溶液也能对过氧化氢的分解起催化作用。对此她做了以下的探究。 ①请你帮助她完成实验报告:
(3)溶质质量分数计算的探究: 他们取了3g MnO2加入到锥形瓶中,向分液漏斗中加入50g过氧化氢溶液,待过氧化氢溶液全部滴加完,并经充分反应后,锥形瓶中剩余物质51.4g,请计算产生氧气的质量是多少?所用过氧化氢溶液溶质的质量分数为多少? |
参考解答
| (1)E G;反应的速率过快;通过控制分液漏斗的活塞,可以控制过氧化氢溶液的滴加速率,控制反应速率 (2)①带火星的木条复燃;CuSO4溶液可以催化分解H2O2 ②H2O,过氧化氢溶液中就有水 (3)解:共收集到氧气质量为:3g+50g-51.4g= 1.6g 设过氧化氢溶液溶质的质量分数为x%。 2H2O2 MnO2 2H2O + O2↑ 68 32 50gx% 1.6g 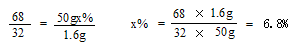 答:产生氧气质量为1.6g,所用过氧化氢溶液溶质的质量分数为6.8% 。 |
分析:(1)根据过氧化氢制取氧气的反应原理是2H2O2 2H2O+O2↑,其中氧气的密度比空气略大,不易溶于水,判断其收集装置;泡沫产生的原因可从双氧水浓度、氧气密度、试管容积等方面考虑.从分液漏斗的优点可知道,它可以控制滴入液体的速度即可控制反应的速率. 2H2O+O2↑,其中氧气的密度比空气略大,不易溶于水,判断其收集装置;泡沫产生的原因可从双氧水浓度、氧气密度、试管容积等方面考虑.从分液漏斗的优点可知道,它可以控制滴入液体的速度即可控制反应的速率.(2)真正起到催化作用的是盐溶液中的金属离子,不是酸根离子,也不是水,根据实验现象或结论完成表格. (3)应用质量守恒定律和根据化学方程式进行计算 解答:解:过氧化氢制取氧气的反应原理是2H2O2  2H2O+O2↑,其中氧气的密度比空气略大,不易溶于水. 2H2O+O2↑,其中氧气的密度比空气略大,不易溶于水.(1)所以收集装置应该用向上排空气法或排水法,他该选择的收集装置是E或G. 泡沫产生可能的原因有:双氧水浓度太大或氧气密度比空气大或试管容积太小或MnO2较多(答出其中两点即可,其他合理答案均可). 反应装置换成B,用分液漏斗可以控制双氧水滴加的量,即可控制反应的速率. 故答案为:E;G;反应的速率过快;通过控制分液漏斗的活塞,可以控制过氧化氢溶液的滴加速率,控制反应速率 (2)①根据所给的实验结论可推出反应发生有氧气生成,所以实验现象为:带火星的木条复燃. 故答案为:①带火星的木条复燃;CuSO4溶液可以催化分解H2O2 ②合①②中得出的结论可知,起到催化作用的是盐溶液中的金属离子,不是酸根离子. 故答案为:H2O,过氧化氢溶液中就有水 (3)解:共收集到氧气质量为:3g+50g-51.4g= 1.6g 设过氧化氢溶液溶质的质量分数为x%。 2H2O2 MnO2 2H2O + O2↑ 68 32 50gx% 1.6g 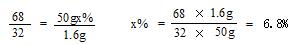 答:产生氧气质量为1.6g,所用过氧化氢溶液溶质的质量分数为6.8% 。 |
相似问题
(6分)实验室常用下列装置研究气体的制取和性质 根据所学知识回答下列问题。 (1)写出实验室制
(6分)实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题。 (1)写出实验室制取氧气的一个化学方程式。利用该反应制取氧气发生装置应选(
下列不属于缓慢氧化的是A.铁生锈B.酿酒C.食物腐烂D.蜡烛燃烧
下列不属于缓慢氧化的是A.铁生锈B.酿酒C.食物腐烂D.蜡烛燃烧
(5分)实验室制取气体所需装置如下图所示。A B C
(5分)实验室制取气体所需装置如下图所示。A B C D E请回答以下问题:(1)装置中标“a”的仪器名称是。(2)用双氧水制取氧气时,所选用的发生装置
下列有关实验现象的描述 正确的是A.硫在空气中燃烧 产生蓝紫色火焰B.木炭在氧气中燃烧 产生有刺激性
下列有关实验现象的描述,正确的是A.硫在空气中燃烧,产生蓝紫色火焰B.木炭在氧气中燃烧,产生有刺激性气味的气体C.细铁丝在氧气中剧烈燃烧,火星四射
根据下列实验装置图回答:(仪器装置可用序号填写) A B
根据下列实验装置图回答:(仪器装置可用序号填写) A B C D E(1)写出标有序号的仪器名称:①② 。(2)用高锰酸钾制取氧气应选用的发生装置是 ,












