将硼酸 发烟硫酸 萤石粉共热得到无色气体A A为平面构型分子 密度约为空气的2.3倍 A用乙醚吸收后
| 将硼酸、发烟硫酸、萤石粉共热得到无色气体A,A为平面构型分子,密度约为空气的2.3倍,A用乙醚吸收后得到液态物质B。液态乙酸中存在微弱的自偶电离,离子电导率为139μS/cm,将B加入乙酸中形成均一透明的无色溶液,发现乙酸的离子电导率显著增强,达到1300-5800μS/cm,B与乙酸的混合溶液是具有良好应用前景的非水型电解质,与传统的水溶液电解质体系相比有独特的优势,扩大了电化学反应研究的物质范围和电位研究区间。试回答下列问题: ⑴ 写出A、B的结构简式 A _____________,B______________ ⑵ 写出生成A的化学反应方程式____________________________________ ⑶ 用方程式表示乙酸的自偶电离过程,并分析乙酸中加入B后,电导率显著提高的原因 ⑷ 红外光谱显示,纯乙酸中存在两种羧羟基吸收峰,分析这两种峰产生的原因 ⑸ 为什么说非水型电解质可以扩大电化学反应研究的物质范围和电位区间? |
参考解答
| ⑴ A:BF3, B:(CH3CH2)2O·BF3 (2分,各1分) ⑵ 3H2SO4 + 2H3BO3 + 3CaF2 ='==' 2BF3 + 3CaSO4 + 6H2O 2分 ⑶ 2CH3COOH 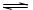 CH3COOH2+ + CH3COO-,加入(CH3CH2)2O·BF3后,(CH3CH2)2O·BF3 CH3COOH2+ + CH3COO-,加入(CH3CH2)2O·BF3后,(CH3CH2)2O·BF3是强路易斯酸,形成了CH3COOBF3-离子,促进了乙酸的自偶电离 2CH3COOH + BF3 ='=' CH3COOBF3- + CH3COOH2+ (2分) ⑷ 乙酸中存在单分子和缔合分子两种状态 (1分) ⑸ 水溶液中难溶或不溶的物质在非水电解质中可以研究,故扩大了研究的物质范围;在水溶液中,电解电位受到析氢电位和析氧电位的区间限制,而非水电解质中扩大了研究的电位区间限制。(意思对即可)(2分) |
| ⑴ A的摩尔质量约为29×2.3=67(g/mol),且为平面分子,结合反应物中存的原子种类,可以推测A为BF3,经验证正确。B为BF3与O(CH2CH3)2的简单加合产物,即F3B←O(CH2CH3)2。 ⑵ A的生成过程可以看成是两个反应的结果,即CaF2与浓H2SO4反应生成HF,然后生的HF迅速与H3BO3发生化学反应生成BF3和水。当然也可以把两个方程式写成一个反应方程式:3H2SO4 + 2H3BO3 + 3CaF2 ='==' 2BF3 + 3CaSO4 + 6H2O。 ⑶ 自偶电离过程,可以与水的自偶电离进行类比。因此乙酸的自偶电离过程可表示为:2CH3COOH 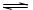 CH3COOH2+ + CH3COO-,即乙酸分子之间H+的传递过程。当乙酸中加入B后,溶液导电能力明显增加,说明溶液中可以“自由”移动离子浓度增加,也就是说B的加入促进了乙酸的电离,这是因为BF3是强的路易斯酸,它能与CH3COO-形成稳定的配合物,从而促进了乙酸的电离。 CH3COOH2+ + CH3COO-,即乙酸分子之间H+的传递过程。当乙酸中加入B后,溶液导电能力明显增加,说明溶液中可以“自由”移动离子浓度增加,也就是说B的加入促进了乙酸的电离,这是因为BF3是强的路易斯酸,它能与CH3COO-形成稳定的配合物,从而促进了乙酸的电离。⑷ 在单分子的乙酸,由于只存在一种化学环境的羧羟基,因此只能在红外光谱中观察到一种吸收峰。但是在实际情况中存在两种红外吸收峰,也就意味着存在两种不同化学环境的羧羟基,结合乙酸的性质,说明纯乙酸中,有一部分乙酸以单分子形式存在,也存在一部分因氢键形成了双聚的乙酸分子。 ⑸ 水溶液中难溶或不溶的物质在非水电解质中可以研究,故扩大了研究的物质范围;在水溶液中,电解电位受到析氢电位和析氧电位的区间限制,而非水电解质中扩大了研究的电位区间限制。 |
相似问题
下列说法中正确的是A.分子中共价键键能越高 键长越长 则分子越稳定B.元素周期表中的ⅡA族和ⅦA族元
下列说法中正确的是A.分子中共价键键能越高,键长越长,则分子越稳定B.元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键C.水分子可表示为H—O—
下列关于氨气和甲烷的说法不正确的是A.两种分子的VSEPR模型相同B.NH3分子中N原子形成三个杂化
下列关于氨气和甲烷的说法不正确的是A.两种分子的VSEPR模型相同B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一对
下列说法不正确的是①离子化合物不可能全部由非金属元素组成;②非金属单质中一定含有共价键;③共价化合物
下列说法不正确的是①离子化合物不可能全部由非金属元素组成;②非金属单质中一定含有共价键;③共价化合物中可能含有离子键;④离子化合物中可能含有共
下列物质中只含有离子键的是( )A.HIB.NaOHC.H2D.NaCl
下列物质中只含有离子键的是()A.HIB.NaOHC.H2D.NaCl
下列叙述中正确的是A.阳离子一定含有金属元素 阴离子一定只含有非金属元素B.某金属元素的阳离子和某
下列叙述中正确的是A.阳离子一定含有金属元素, 阴离子一定只含有非金属元素B.某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物C.阴












