(15分)X Y Z Q W为按原子序数由小到大排列的五种短周期元素 已知:①X元素与Q处于同一主族
| (15分)X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知: ①X元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q的。 ②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。 ③Z元素的电离能数据见下表(kJ·mol-1):
请回答: (1)XY2分子空间构型为 ,X原子的轨道杂化方式为 ;QX的晶体结构与金刚石的相似,其中X原子的杂化方式为 ,微粒间存在的作用力是 。 (2)晶体ZW的熔点比晶体XW4明显高的原因是 。 (3)氧化物MO的电子总数与QX的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是_________________________。 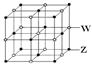 (4)ZW晶体的结构示意图如右图。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023mol-1,则ZW晶体中两个最近的Z离子中心间的距离为 。 |
参考解答
| ⑴ 直线型分子; sp杂化; sp3杂化;共价键 ; ⑵NaCl为离子晶体而CCl4为分子晶体; ⑶Mg Mg2+半径比Ca2+小,MgO晶格能大 ⑷ 4.0×10-8 cm |
试题分析:根据题意可推知各种元素分别为:X是C;Y的O;Z是Na;Q是Si;W是Cl。(1)CO2分子空间构型为直线型;其中X原子的轨道杂化方式为sp杂化;SiC的晶体结构与金刚石的相似,是原子晶体,其中C原子的杂化方式为sp3杂化;C原子与Si原子之间的作用力是共价键。(2)NaCl晶体是离子晶体,离子间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此该化合物的熔点高;而CCl4是由分子通过分子间作用力结合,分子间作用力是一种比较弱的作用,破坏比较容易,因此该晶体的熔沸点比较低,CCl4在室温下为液态。(3)SiC的电子数是20,而氧化物MO的电子总数与SiC的相等,则M的电子数是12,该元素是Mg;MgO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MgO的熔点比CaO的高,是因为Mg2+半径比Ca2+小,MgO晶格能大,断裂其离子键比CaO难,所以熔点较高。(4)在一个晶胞中含有的Na+:8×1/8+6×1/2=4;含有的Cl-:12×1/4+1=4.即一个晶胞中含有4个NaCl.所以晶胞的边长为L,则 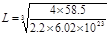 在晶胞中两个最近的Na+的距离是 在晶胞中两个最近的Na+的距离是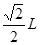 整理解得 整理解得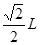 =4.0×10-8 cm。 =4.0×10-8 cm。 |
相似问题
短周期元素X Y Z的原子序数依次递增 其原子的最外层电子数之和为13。X与Y Z位于相邻周期 Z原
短周期元素X,Y,Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y,Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外
J L M R T是原子序数依次增大的短周期主族 元素 J R在周期表中的相对位置如下表;J元素最低
J、L、M、R、T是原子序数依次增大的短周期主族 元素,J、R在周期表中的相对位置如下表;J元素最低负 化合价的绝对值与其原子最外层电子数相等;M是地壳
原子序数依次增大的A B C D E F六种元素。其中A的基态原子有3个不同的能级 各能级中的电子数
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相
A B C D E五种短周期元素(A B C D E分别代表元素符号) 它们的原子序数依次增大;A是
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应
(1)CH3+ -CH3(甲基) CH3-都是重要的有机反应中间体 有关它们的说法正确的是A.它们
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是A.它们均由甲烷去掉一个氢原子所得B.它们互为等电子体,碳原子均采取sp2












