卤族元素是典型的非金属元素 包括F Cl Br I等。请回答下面有关问题(1)同主族元素的电负性大小
| 卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题 (1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。 (2)Br原子的M层核外电子排布式为_________。 (3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。 (4)CCl4分子中碳原子的杂化方式为______,NF3分子的空间构型为_______。 (5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。 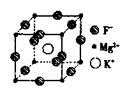 |
参考解答
| (1)I Br Cl F (2)3s23p63d10 (3)直线型 120。 (4)sp3 三角锥形 (5)20% |
| (1)非金属性越强,电负性越大,即电负由小到大的顺序是I Br Cl F; (2)Br是第四周期元素,其M层电子排布式为3s23p63d10 (3)BeCl2中含有的孤对电子对数是(2-2×1)/2=0,所以BeCl2是直线型。BF3是平面正三角型,键角是120。 (4)CCl4是正四面体,C原子采取的是sp3杂化;N原子含有孤对电子对数是=(5-3×1)/2=1,且AB3型,所以NF3是三角锥型。 (5)该晶胞中含Mg(8×1/8)=1个,K原子个数为1,F原子数为12×1/4=3,所以其化学式为KMgF3,由化学式可算出Mg的质量分数为20% |
相似问题
X Y Z L M五种元素的原子序数依次增大。X Y Z L是组成蛋白质的基础元素 M是地壳中含量最
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:(1)L的元素符号为_______
[物质结构与性质]碳是形成化合物种类最多的元素。(1)CH2=CH—C≡N是制备腈纶的原料 其分子中
[物质结构与性质]碳是形成化合物种类最多的元素。(1)CH2=CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为________(填最简整数比),写出该分子
VIA族的氧 硫 硒(Se) 碲(Te)等元素在化合物中常表现出多种氧化态 含VIA族元素的化合物在
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:(1)S单质的
已知W D E X Y Z是六种短周期主族元素。元素W与元素Y位于同一主族。X W E三元素位于同一
已知W、D、E、X、Y、Z是六种短周期主族元素。元素W与元素Y位于同一主族。X、W、E三元素位于同一周期,且原子序数依次增大。D、W在周期表中的位置如图。请
短周期元素Q R T W在元素周期表中的位置如下图所示 期中T所处的周期序数与主族序数相等 请回答下
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:(1)元素的非金属性为(原子的得电子能力












