(1)图1所示一些晶体的结构(晶胞) 其中代表干冰的是______;(2)MgO晶胞空间构型与NaC
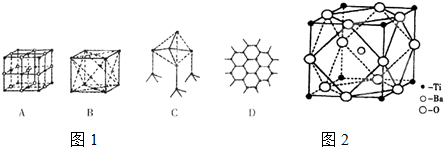 (1)图1所示一些晶体的结构(晶胞),其中代表干冰的是______; (2)MgO晶胞空间构型与NaCl晶体相同,MgO晶体中Mg2+的配位数为______.与同个Mg2+等距且最近的O2-围成的空间几何构型是______.MgO晶体熔点高于NaCl晶体,原因是______; (3)若C、D代表某种元素中的两种同分异构体,C中原子的杂化类型是______,属于______晶体.D中原子的杂化类型是______,D能导电的原因是______; (4)原子晶体能否形成最密堆积结构?______,原因是______; (5)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如 图2所示,它的化学式是______. |
参考解答
| (1)干冰是分子晶体,结合常见晶体可知,其中代表干冰的是B. 故答案为:B. (2)根据氯化钠的配位数知,氧化镁晶体中镁离子的配位数是6;同个Mg2+等距且最近的O2-围成的空间几何构型是正八面体;电荷越大、离子半径越小其熔点越高,MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl,所以MgO晶体熔点高于NaCl晶体. 故答案为:6;正八面体;MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl. (3)C中每个原子含有4个σ键,所以采取sp3杂化,该物质中构成了一个空间网状结构,所以属于原子晶体; D中每个原子含有3个σ键,所以采取sp2杂化;导体能导电的原因是导体中含有在电流作用下能自由移动的电子,石墨是导体,每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子),所以能导电. 故答案为:sp3杂化、原子、sp2杂化、每个碳原子上未参与杂化的一个2p轨道上电子在层内离域运动(石墨中有自由电子). (4)原子晶体中共价键有饱和性且配位数远小于12,所以不能形成最密堆积结构. 故答案为:不能;共价键有饱和性且配位数远小于12. (5)该晶胞中含有一个钡原子,含有钛原子个数=8×
故答案为:BaTiO3. |
相似问题
通常状况下 NC13是一种油状液体 其分子空间构型与氨分子相似 下列对NC13的有关叙述正确的是(
通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是( )A.CCl4中C-C1键键长比NC13中N-C1键键长短B.分子
氯化硼的熔点为-107℃ 沸点为12.5℃ 在其分子中键与键之间的夹角为120° 它能水解 有关叙述
氯化硼的熔点为-107℃,沸点为12 5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )A.氯化硼分子呈正三角形,属非极性分子B
(三选一)【化学--选修 物质结构与性质】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下(
(三选一)【化学--选修物质结构与性质】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下(1)已知在反应①、②中均生成相同的气体分子,该气体具有
下列各组分子中 都属于含极性键的非极性分子的是 [ ]A.CO2
下列各组分子中,都属于含极性键的非极性分子的是[ ]A.CO2H2S B.C60C2H4 C.C2H4CH4D.NH3HCl
下列有关杂化轨道的说法中错误的是( )A.ⅠA族元素成键时不可能有杂化轨道B.s轨道和p轨道不可能
下列有关杂化轨道的说法中错误的是( )A.ⅠA族元素成键时不可能有杂化轨道B.s轨道和p轨道不可能有sp4出现C.杂化轨道既可能形成σ键,也可能形成π












