超细铜粉主要应用于导电材料 催化剂等领域中.超细铜粉的某制备方法如下:试回答下列问题:(1)下列关于
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下: 试回答下列问题: (1)下列关于[Cu(NH3)4]SO4的说法中,正确的有______.(填字母序号) A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 (2)NH4CuSO3中的金属阳离子的核外电子排布式为:______. (3)SO
(4)NH3易液化的原因是______. (5)如图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为______. (6)NH4CuSO3与硫酸微热时除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体.则该反应的离子方程式为______. 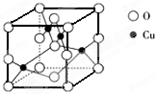 |
参考解答
| (1)A.[Cu(NH3)4SO4中硫酸根离子和[Cu(NH3)42+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4SO4中所含的化学键有共价键、离子键、配位键,故A正确; B.NH3为配体分子,溶液中不存在NH3,故B错误; C..元素周期律中,同一周期元素的第一电离能随着原子序数的增大而增大,但N原子最外层达到半饱和的稳定结构,难以失去电子,所以其第一电离能大小为N>O,故C错误 D.SO42-离子中价层电子对数为4+
故答案为:AD. (2)Cu原子的核外电子排布式为[Ar3d104s1,NH4CuSO3中Cu的化合价为+1价,则金属阳离子的核外电子排布式为 [Ar3d10,故答案为[Ar3d10: (3)SO32-中含有3个δ键和1个孤电子对,故为sp3杂化,离子含有4的原子,价电子总数为26,对应的等电子体有NF3(或PF3、NCl3、PCl3等),故答案为:sp3;NF3(或PF3、NCl3、PCl3等); (4)N元素的非金属性较强,对应的氢化物中含有氢键,沸点较高,易液化,故答案为:NH3分子间可形成氢键, (5)晶胞中4个Cu位于晶胞内部,O位于晶胞的顶点和面心,共有8×
故答案为:CuO; (6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu2+和SO2,反应的离子方程式为2NH4CuSO3 +4H+
故答案为:2NH4CuSO3 +4H+
|
相似问题
下列叙述正确的是 [ ]A.NH3是极性分子 分子中N原子是在3个H原子所组成的三角形的中心
下列叙述正确的是 [ ]A.NH3是极性分子,分子中N原子是在3个H原子所组成的三角形的中心 B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方
碘单质在水中的溶解度很小 但在CCl4中的溶解度很大 这是因为[ ]A. CCl4与I2的相
碘单质在水中的溶解度很小,但在CCl4中的溶解度很大,这是因为[ ]A CCl4与I2的相对分子质量相差较小,而H2O与I2的相对分子质量相差较大B CCl4和I2都
根据“三氟化硼→正三角形→非极性分子”的因果关系 则“三氯甲烷→( ①)→( ②)”的因果关系是 _
根据“三氟化硼→正三角形→非极性分子”的因果关系,则“三氯甲烷→(①)→(②)”的因果关系是 _______.A、正四面体B、非正四面体C、非极性分子D、
有关苯分子中的化学键描述正确的是[ ]A.每个碳原子的sp2杂化轨道中的一个形成大π键 B.
有关苯分子中的化学键描述正确的是[ ]A.每个碳原子的sp2杂化轨道中的一个形成大π键 B.每个碳原子的未参加杂化的2p轨道形成大π键C.碳原子的三个sp2
铵根离子中存在的化学键类型按离子键 共价键和配位键分类 应含有 ( )A.离子键和共价键B.离
铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有()A.离子键和共价键B.离子键和配位键C.配位键和共价键D.离子键












