A B C D E F G全为短周期元素 它们在中学常见化合物中显示的部分化合价及原子 离子半径从大
A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式______. (3)请设计实验比较B、F的活动性强弱.
|
参考解答
| A的最高正价为+7价,为第ⅦA族元素,对应离子半径最大,则应为Cl元素,B的化合价只有+2价,为第ⅡA族元素,根据原子半径判断应为Mg元素,C的化合价为+4价,且原子半径大于Cl,应为Si元素,D的化合价为-3、+2、+4、+5,可以判断应为N元素,E只有-1价,应为F元素,F只有+3价,应为Al元素,G只有+1价,且原子半径最大,应为Na元素, (1)A为Cl元素,B为Mg元素,二者形成的化合物为离子化合物,用电子式表示的形成过程为 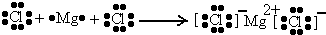 , 故答案为: 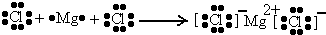 . (2)F为Al元素,最高价氧化物对应的水化物为Al(OH)3,具有两性,G的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠和水,反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O, 故答案为:Al(OH)3+OH-═AlO2-+2H2O. (3)B为Mg元素,F为Al元素,Mg的金属性较Al强,可用金属与稀硫酸反应,比较反应的剧烈程度,金属越活泼,与酸反应越剧烈,故答案为:
|
相似问题
短周期元素X原子核外的电子处于n个电子层上 最外层电子数为(2n+1) 核内质子数为(2n2-1).
短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1).有关X的说法中不正确的是( )A.X元素气态氢化物的水
A B C是周期表中相邻的三个元素 A和B是同周期 B和C同主族 三种元素最外层电子总数之和为17
A、B、C是周期表中相邻的三个元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A、B、C三种元素是( )A.Mg
A元素的原子最外层有3个电子 B元素的原子最外层有7个电子 当它们失去或得到电子形成稳定结构时 A的
A元素的原子最外层有3个电子,B元素的原子最外层有7个电子,当它们失去或得到电子形成稳定结构时,A的化合价为______,B的化合价为______,A与B结合形成
已知X Y是主族元素 X2+ Y-与氩原子的电子层结构相同 下列判断不正确的是( )A.原子半径X
已知X、Y是主族元素,X2+、Y-与氩原子的电子层结构相同,下列判断不正确的是( )A.原子半径X>YB.原子序数X>YC.最外层电子数X>YD.电子层数X>Y
下列说法中 不正确的是( )A.原子最外层电子数比次外层电子数多的元素一定位于第二周期B.从氟到碘
下列说法中,不正确的是( )A.原子最外层电子数比次外层电子数多的元素一定位于第二周期B.从氟到碘,单质与氢气发生化合反应越来越难C.14C和14N两












