晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体(如图)。其中含20个等边三角形和一定数量
晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体(如图)。其中含20个等边三角形和一定数量的顶角,每个顶角上各有一个原子。试观察推断这个基本结构单元所含B原子数,B—B键个数及键角正确的一组是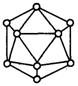
|
参考解答
| B |
| 略 |
相似问题
下列叙述中正确的是( )A.熔化状态下能导电的物质一定是离子化合物B.P4和NO2都是共价化合
下列叙述中正确的是( )A.熔化状态下能导电的物质一定是离子化合物B.P4和NO2都是共价化合物C.在氧化钙和二氧化硅晶体中都不存在单个的小分子D.离子化
下列判断正确的是
下列判断正确的是()A.非金属氧化物一定是酸酐B.酸酐一定是非金属氧化物C.晶体中一定存在化学键D.碱性氧化物一定是金属氧化物
离子键的强弱主要决定于离子的半径和离子电荷值。一般规律是:离子半径越小 离子电荷值越大 则离子键越强
离子键的强弱主要决定于离子的半径和离子电荷值。一般规律是:离子半径越小,离子电荷值越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺
下列不属于金属晶体共性的是( )A.易导电B.易导热C.有延展性D.高熔点
下列不属于金属晶体共性的是( )A.易导电B.易导热C.有延展性D.高熔点
(6分)请回答下面问题(1)Mg是第三周期元素 该周期部分元素氟化物的熔点见下表:氟化物NaFMgF
(6分)请回答下面问题(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:氟化物NaFMgF2SiF4熔点 K12661534183解释表中氟化物熔点差异的原因:












