(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心 ○位于大立方体
(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 (用化学式表示)。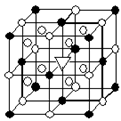 (2)H2S和H2O2的主要物理性质比较如下:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因 。 (3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有_______(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。 |
参考解答
| (共15分) A(1)●:AlF63- ○:Na+ Na+ (各2分) (2)H2O2分子间存在氢键,与水分子可形成氢键(3分)。 (3) Cr(2分) 共价键、配位键(2分) 降低Cu(NH3)4SO4·H2O的溶解度(2分) |
试题分析:(1)黑球在八个顶点和六个面心:8*1/8+6*1/2='4' ;白球位于大立方体的12条棱的中点和8个小立方体的体心:12*1/4+8='11' Na+: AlF63-=3:1 多的是白球代表Na+,11个满足3:1,▽代表Na+;黑球代表AlF63-。 (2)氢键能使溶沸点升高,与水分子形成氢键,使溶解度增大。 (3)铜的外围电子排布:3d104s1 铬的外围电子排布:3d54s1。它们的最外层电子数相同,为1. Cu(NH3)4SO4·H2O是极性分子,而C2H5OH极性很弱,根据相似相溶原理,Cu(NH3)4SO4·H2O在C2H5OH溶解度变小。 |
相似问题
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N—N—N键角都是
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N—N—N键角都是108 1°,下列有关 N(NO2)3的说法正确的是( )
目前普遍认为 质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克的带电量为2e/3 d夸克的
目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。u夸克的带电量为2e 3,d夸克的带电量为-e 3,e为基本电荷。下表中关于质子和中子组成
某元素原子核内质子数为m 中子数为n 则下列论断正确的是[ ]A.这种元素的相对原子质量为m
某元素原子核内质子数为m,中子数为n,则下列论断正确的是[ ]A.这种元素的相对原子质量为m+n B.不能由此确定该元素的相对原子质量 C.若碳原子质量
下列分子结构:CO2 CH4 PCl5 Na2O2 MgF2 其中原子的最外层不能都满足8电子稳定结
下列分子结构:CO2、CH4、PCl5、Na2O2、MgF2,其中原子的最外层不能都满足8电子稳定结构的是;属于离子化合物,且离子个数之比是2:1或1:2的是。
下列各组分子中 中心原子均采取sp3不等性杂化的是A.PCl3 NH3B.BF3 H2OC.CCl4
下列各组分子中,中心原子均采取sp3不等性杂化的是A.PCl3、NH3B.BF3、H2OC.CCl4、H2SD.BeCl2、BF3












