如图装置所示 C D E F X Y都是惰性电极 甲 乙中溶液的体积和浓度都相同(假设通电前后溶液体
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.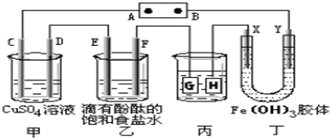 请回答: (1)B极是电源的______极,一段时间后,甲中溶液颜色______,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明______在电场作用下向Y极移动; (2)电解一段时间内甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为______,乙中发生反应的离子方程式为______,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的______;(填物质的化学式) (3)现用丙装置给铜件镀银,则H应该是______(填“镀层金属”或“镀件”).当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为______,甲中溶液的pH______(填“变大”、“变小”或“不变”); (4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是______. |
参考解答
| 将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极; (1)B电极是电源的负极,在A池中,电解硫酸铜的过程中,铜离子逐渐减少,导致溶液颜色变浅,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,故答案为:逐渐变浅;氢氧化铁胶体粒子带正电荷; (2)C、D、E、F电极发生的电极反应分别为:4OH-═O2↑+2H2O+4e-、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,乙中电解饱和食盐水发生的离子方程式为2Cl-+2H2O
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中氢氧根减少,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH 变小,故答案为:镀件;5.4g;变小; (4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+
|
相似问题
Fe Cu Al是常见的金属元素 按要求回答下列问题:(1)向氯化铜溶液中加入一定量的铁粉和铝粉混合
Fe、Cu、Al是常见的金属元素,按要求回答下列问题:(1)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分 反应后,下列情况可能出现的是________(填
三氧化二镍(Ni2O3)可用于制造高能电池 其电解法制备过程如下:用NaOH调NiCl2溶液pH至7
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7 5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间 假设电解时温度不变且用惰性电极
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )A.当电池负极消
工业生产中常利用电解反应来制取新的物质 填写下表中电解各物质时阳极(和电源正极相连的极) 阴极(和电
工业生产中常利用电解反应来制取新的物质,填写下表中电解各物质时阳极(和电源正极相连的极)、阴极(和电源负极相连的极)所得产物的化学式.饱和食盐
某溶液只含有NaCl和H2SO4两种溶质 它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段.下列叙述不正确的是(












