日常生活中食用的食盐大多来自海水晾晒.可得到含少量泥沙的粗盐.以下为粗盐的简要精制和除杂过程.(1)
| 日常生活中食用的食盐大多来自海水晾晒.可得到含少量泥沙的粗盐.以下为粗盐的简要精制和除杂过程. (1)海边的盐民多在夏天晾晒海盐.根据右图分析,夏天有利于得到粗盐是因为______. 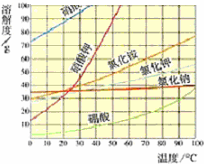 (2)海水晾晒得到的粗盐中往往含有少量泥沙,为了除去泥沙等不溶物,某小组设计了如图所示的实验. 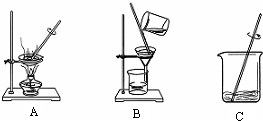 在粗盐提纯的操作中,正确的操作顺序为(填序号)______, 其中A、B的操作名称为______,B中的玻璃棒的作用为______. (3)除去泥沙后的食盐中,通常还含有氯化钙、氯化镁、硫酸镁等可溶杂质.要除去这些杂质,选择的药品和加药的顺序均正确的是(填序号)______. ①Na2CO3、BaCl2、NaOH ②Ba(NO3)2、NaOH、Na2CO3 ③BaCl2、NaOH、K2CO3、HCl ④BaCl2、NaOH、Na2CO3、HCl (4)某小组量取了10.0mL 水,称取4.0g粗盐,逐渐加入水中,并用玻璃棒不断搅拌,继续操作最终蒸干得3.6g精盐,则精盐的产率是______. |
参考解答
| (1)观察图示可知,氯化钠随温度变化溶解度变化不大,所以夏天便于水分蒸发,且氯化钠随温度变化溶解度变化不大,有利用氯化钠析出,所以是夏天收盐. 故答案为:夏天便于水分蒸发,且氯化钠随温度变化溶解度变化不大,有利用氯化钠析出,所以是夏天收盐. (2)粗盐提纯的主要步骤, ①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊; ②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,如滤液浑浊,应再过滤一次; ③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干. 图中A是蒸发,B是过滤,C是溶解;B过滤实验中玻璃棒的作用是引流. 故答案为:CBA;蒸发;过滤;引流. (3)加入适量的氯化钡溶液,可以将钡离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,过滤可以将沉淀除去,加适量盐酸,可以除去反应剩余的碳酸根离子和氢氧根离子,最后的溶液中就只剩下了氯化钠和水,所以选择的药品和加药的正确顺序确是BaCl2、Na2CO3、NaOH、HCl. 故选④. (4)4.0g粗盐,得3.6g精盐可知,精盐的产率是:
故答案为:90.0%. |
相似问题
浩瀚的海洋蕴藏着丰富的化学资源 我们可以从海水中提取氯化钠等化工原料.现有一包从海水中获得的粗盐 已
浩瀚的海洋蕴藏着丰富的化学资源,我们可以从海水中提取氯化钠等化工原料.现有一包从海水中获得的粗盐,已经过初步提纯,还含有杂质氯化镁、氯化钙.课
我国海洋资源十分丰富.随着科学技术的不断发展 不仅可以通过高分子材料来淡化海水 还可以从海水中提取食
我国海洋资源十分丰富.随着科学技术的不断发展,不仅可以通过高分子材料来淡化海水,还可以从海水中提取食盐、金属镁等重要的化学物质.(1)海水晒盐所
为了除去粗盐中的CaCl2 MgSO4及泥沙 可将粗盐溶于水 然后进行下列5项操作:①过滤;②加过量
为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量
甲酸(HCOOH)是一种无色 有刺激性气味的液体 与浓硫酸混合加热的反应为: HCOOHCO↑+H2
甲酸(HCOOH)是一种无色,有刺激性气味的液体,与浓硫酸混合加热的反应为: HCOOHCO↑+H2O。实验室可利用下图装置制取CO并还原CuO:下列说法错误的是
以下是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验活动中的部分操作.(1)仪器
以下是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验活动中的部分操作.(1)仪器a的名称是______.(2)配制6%的氯化钠溶液和粗












