某同学利用下图装置 研究氯气的性质.请据图回答:(1)该同学制取氯气的反应原理是:______(写离
| 某同学利用下图装置,研究氯气的性质.请据图回答: (1)该同学制取氯气的反应原理是:______(写离子方程式). (2)实验过程中①处观察到的现象是______;②处现象说明氯气具有的性质是______,③处发生反应的离子方程式为______. (3)该实验操作的不足之处是______.工业上将氯气通入消石灰【Ca(OH)2】中,反应所得主要物质可制得______,它是常用的消毒剂.在某温度下,将Cl2通入NaOH溶液中,反应得到含有NaClO与NaClO3物质的量之比为1:1的混合液,此反应的化学方程式是______. 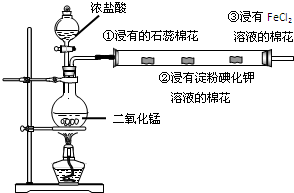 |
参考解答
(1)在加热条件下,二氧化锰和浓盐酸反应生成氯气,离子反应方程式为:MnO2+4H++2Cl-
故答案为:MnO2+4H++2Cl-
(2)氯气和水反应生成HCl和HClO,酸使紫色石蕊试液变红色,但HClO具有漂白性,能使红色褪色,所以看到的现象是棉花先变红后褪色; 氯气具有氧化性,能将碘离子氧化物碘,碘遇淀粉试液变蓝色; 氯气有强氧化性,能将亚铁离子氧化铁离子,自身被还原为氯离子,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-, 故答案为:棉花先变红,后褪色;氧化性;2Fe2++Cl2═2Fe3++2Cl-; (3)氯气有毒不能直接排空,所以要有尾气处理装置,该装置中没有尾气处理装置;氯气和氢氧化钙溶液反应制取漂白粉; NaClO与NaClO3物质的量之比为1:1,设NaClO与NaClO3物质的量都是1mol,根据转移电子相等,得氯离子的物质的量=
故答案为:未进行尾气处理;漂白粉;8NaOH+4Cl2═6NaCl+NaClO+NaClO3+4H2O. |
相似问题
下列实验中 观察不到明显现象的是( )A.有色布条投入干燥的氯气中B.Cl2通入FeCl2溶液中C
下列实验中,观察不到明显现象的是( )A.有色布条投入干燥的氯气中B.Cl2通入FeCl2溶液中C.纯碱溶液滴入醋酸中D.溴水滴加到淀粉KI溶液中
氟气通过NaOH溶液形成氟化钠 同时放出一种无色气体X X由两种元素组成 其中氯元素的质量分数为70
氟气通过NaOH溶液形成氟化钠,同时放出一种无色气体X,X由两种元素组成,其中氯元素的质量分数为70 4%,则下列有关说法正确的是( )A.X气体是HFB.X气体
下列物质中能使湿润的淀粉碘化钾试纸变蓝的是( )A.硝酸钠溶液B.碳酸钾溶液C.氯水D.氯化钠溶液
下列物质中能使湿润的淀粉碘化钾试纸变蓝的是( )A.硝酸钠溶液B.碳酸钾溶液C.氯水D.氯化钠溶液
向某晶体的溶液中加入Fe2+的溶液无明显变化 当滴加几滴氯水后 混合液出现血红色 由此得出的下列结论
向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴氯水后,混合液出现血红色,由此得出的下列结论错误的是( )A.Fe3+的氧化性比氯的氧化性强B
将氯水分别滴入下列溶液中 观察有何现象?① 紫色石蕊试液;② 氯化亚铁溶液;③碳酸钠溶液
将氯水分别滴入下列溶液中,观察有何现象?①紫色石蕊试液;② 氯化亚铁溶液;③碳酸钠溶液












