(12分)【化学-物质结构与性质】原子序数依次增大的A B C D E F六种元素。其中A的基态原子
| (12分)【化学-物质结构与性质】 原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。 (1)F原子基态的核外电子排布式为 。 (2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。 (3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。 (4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。 (5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。 (6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。 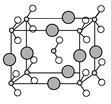 |
参考解答
| (共12分) (1)[Ar3d104s1(2分) (2)N>O>C(2分) (3)B的氢化物分子之间存在氢键(2分) (4)[N=C=O-(2分) (5)sp(2分) (6)NaNO2(2分) |
试题分析:原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素;C的基态原子2p能级上的未成对电子数与A原子的相同,则C原子核外电子排布式为1s22s22p4,故C为O元素,由原子序数可知B为N元素;F的原子序数为29,则F为Cu;E和C位于同一主族,则E为S元素;D为它所在周期中原子半径最大的主族元素,处于ⅠA族,原子序数大于O元素小于S元素,故D为Na。 (1)F原子核外电子数为29,基态的核外电子排布式为[Ar3d104s1。 (2)同周期随原子序数增大元素第一电离能呈增大趋势,但N元素2p能级容纳3个电子,处 于半满稳定状态,能量较低,第一电离能高于氧元素,故第一电离能N>O>C。 (3)NH3分子之间存在氢键,CH4分子间的作用是范德华力,氢键比范德华力更强,故其沸点高于CH4。 (4)OCN-与CO2互为等电子体,价电子总数相等,二者结构类似,则OCN-的结构式为[N=C=O- (5)元素C与S所形成的常见化合物为CS2,CS2的结构类似于CO2,S原子的杂化方式与CO2中C原子的杂化方式相同,为sp杂化。 (6)由晶胞结构可知,晶胞中存在NO2-结构微粒,位于顶点和体心,微粒数目=1+8×1/8=2, Na+位于8条棱的中心,数目=8×1/4=2,故该化合物的化学式为NaNO2。 |
相似问题
下列说法正确的是A.中国是目前全球最大的稀土提炼和加工国 对稀土元素及其化合物的研究是获得优良催化剂
下列说法正确的是A.中国是目前全球最大的稀土提炼和加工国,对稀土元素及其化合物的研究是获得优良催化剂的一种重要途径B.气化、液化和干馏是煤综合利
下列事实中 能说明氯的非金属性比硫强的是 A.高氯酸的酸性比亚硫酸强B.次氯酸的氧化性比稀硫酸强C.
下列事实中,能说明氯的非金属性比硫强的是 A.高氯酸的酸性比亚硫酸强B.次氯酸的氧化性比稀硫酸强C.氯化氢比硫化氢的热稳定性好D.氯原子最外层电子
某同学做元素性质递变规律实验时 自己设计了一套实验方案 并记录了有关实验现象(见下表 表中的“实验步
某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。实验步
对于符号:35Cl和37Cl H2和D2 1H216O和2H218O。下列有关说法正确的是( )A
对于符号:35Cl和37Cl、H2和D2、1H216O和2H218O。下列有关说法正确的是()A.35Cl和37Cl互称为同素异形体B.H2和D2是氢元素的两种同位素C.35和37表示的
1992年 我国取得重大科技成果之一就是发现了三种元素新的同位素 其中一种是 它的中子数为:A.80
1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是,它的中子数为:A.80B.288C.208D.128












