(12分)【选做题】本题包括A B两小题 请选定其中一小题 并在相应的答题区域内作答。若多做 则按A
| (12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。 A.[物质结构与性质] 元素X基态原子的p电子比s电子少1个。元素Y基态原子的2p电子是2s电子的2倍。元素Z的一种单质为自然界硬度最大的物质。元素M位于第四周期,其基态原子失去3个电子后3d轨道半满。 (1)X、Y、Z的基态原子,第一电离能由大到小的顺序是 。 (2)X的氢化物易于液化,其原因是 。 (3)X与M形成的一种化合物晶胞结构如图所示。 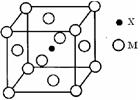 ①每个晶胞中M离子的数目为 ; ②该化合物的化学式为 。 (4)Y可形成单质Y3 ①Y3分子的空间构型为 (用文字描述)。 ②写出一种与Y3互为等电子体的分子的化学式: 。 (5)Y、Z的化合物ZY可与M的单质生成配合物M(ZY)5,该配合物中σ键与π键的个数比为 。 |
参考解答
| (1)N>O>C (2分)(2)氨分子间形成氢键 (2分)(3)①4 ②Fe4N (各1分) (4)①V型(或折线型) (2分)②SO2 (2分)(5)1∶1 (2分) |
试题分析:元素X基态原子的p电子比s电子少1个,则电子排布为1s22s22p3,为N元素;元素Y基态原子的2p电子是2s电子的2倍,则2p轨道排布4个电子,为O元素;元素Z的一种单质为自然界硬度最大的物质,则元素Z为C元素;元素M位于第四周期,其基态原子失去3个电子后3d轨道半满,则M基态原子3 d轨道排布6个电子,为Fe元素。 (1)N元素2p轨道排布3个电子,为稳定状态,所以第一电离能由大到小顺序为:N>O>C (2)N原子半径小,电负性大,氨分子间容易形成氢键,所以NH3易液化。 (3)①M位于8个顶点和6个面心,根据均摊法,每个晶胞含Fe:8×1/8+6×1/2=4。 ②N原子位于晶胞中心,含有1个N原子,所以化学式为:Fe4N (4)①O3中心O原子形成了2个O-O键,含有2对孤对电子,为sp3杂化,所以空间构型为V型(或折线型)。 ②含有原子数和价电子数相等的微粒为等电子体,与O3互为等电子体的分子的化学式为SO2 (5)配合物M(ZY)5,为Fe(CO)5,含有5个σ键和5个π键,所以该配合物中σ键与π键的个数比为1:1。 |
相似问题
下列各组中属于同位素的是( )。A.40K与40CaB.35Cl2和37Cl2C.D与TD.金
下列各组中属于同位素的是( )。A.40K与40CaB.35Cl2和37Cl2C.D与TD.金刚石与石墨
(15分)A B C D E为原子序数依次增大的元素 其中只有E不属于短周期 相关信息如下表:元素A
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:元素ABCDE相关信息最高正价与最低负价代数和为2与元素C可形成
O W X Y Z五种短周期元素在元素周期表中的相对位置如图所示 W是大气中含量最高的元素 由此可知
O、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,W是大气中含量最高的元素,由此可知A.Q的一种核素中的质子数和中子数相等B.X的最高正
香花石被誉为“矿石熊猫” 由我国地质学家首次发现 它由前20号元素中的6种组成 其化学式为X3Y2(
香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数
下列说法正确的是A.流水 风力是一次能源 电力 蒸汽是二次能源B.普通锌锰电池是一次电池 碱性锌锰电
下列说法正确的是A.流水、风力是一次能源,电力、蒸汽是二次能源B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池C.同周期元素形成的简单离子中,原












