(12分)W X Y Z是原子序数依次增大的短周期元素 它们中的两种或三种元素组成化合物甲 乙 丙
| (12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液 PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: 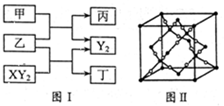 (1)甲与乙反应的化学方程式是______。 (2)甲的中心原子杂化轨道类型为_____; XY2分子中, 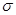 键与π键的数目之比为_________; 键与π键的数目之比为_________;XY2原子晶体的1个晶胞中含有_______个原子。 W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。 工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。 |
参考解答
| (12分,每空2分) (1)2Na2O2+2H2O==4NaOH+O2↑ (2)sp3 1∶1 24 (3)O>C>H>Na (4)2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O |
试题分析:常温下0.01mol/L-1丙溶液PH=12,说明丙为强碱,短周期元素形成,应为NaOH,根据反应框图可知:甲为H2O,乙为Na2O2,XY2为CO2,Y2为O2,丁为Na2CO3,W、X、Y、Z是原子序数依次增大的短周期元素,分别为:H、C、O、Na。 (1)甲为H2O,乙为Na2O2,所以化学方程式为:2Na2O2+2H2O==4NaOH+O2↑ (2)甲的中心原子为O,O形成了2个σ键,还有2对孤对电子,所以杂化方式为sp3;CO2分子结构式为:O=C=O,含有2个σ键和2个π键,所以σ键与π键的数目之比为1:1;根据CO2的原子晶体晶胞图,C分子位于8个顶点,6个面心和4个晶胞内部,则含C原子:8×1/8+6×1/2+4=8,O原子都位于晶胞内部,16个,所以1个晶胞中含有24个原子。 (3)根据H、C、O、Na在元素周期表中的位置可知电负性由大到小的顺序是:O>C>H>Na (4)次氯酸中Cl元素的化合价为+1,则次氯酸的酸酐为Cl2O,氯气与潮湿的丁反应制备次氯酸的酸酐,同时生成小苏打和食盐混合物,所以化学方程式为:2Cl2+2Na2CO3+H2O==2NaCl+2NaHCO3+Cl2O |
相似问题
(3分)(2012?山东)下列关于原子结构 元素性质的说法正确的是( )A.非金属元素组成的化合物
(3分)(2012?山东)下列关于原子结构、元素性质的说法正确的是( )A.非金属元素组成的化合物中只含共价键B.ⅠA族金属元素是同周期中金属性最强的
【化学--选修3物质结构与性质】(15分)铜 铁都是日常生活中常见的金属 它们的单质及其化合物在科学
【化学--选修3物质结构与性质】(15分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
已知钋的原子序数是84 是一种放射性元素 被称为世界上最毒的物质。钋在元素周期表中的位置是A.第七周
已知钋的原子序数是84,是一种放射性元素,被称为世界上最毒的物质。钋在元素周期表中的位置是A.第七周期第ⅥA族B.第六周期第ⅥA族C.第六周期第ⅡA族D
五种短周期元素的某些信息如表所示:元素有关信息X最高价氧化物对应的水化物能与其气态氢化物反应生成盐Y
五种短周期元素的某些信息如表所示:元素有关信息X最高价氧化物对应的水化物能与其气态氢化物反应生成盐YM层上有3个电子Z短周期元素中原子半径最大的主族
运用元素周期律分析下面的推断 其中错误的是( )A.铍(Be)的氧化物的水化物可能具有两性B.砹
运用元素周期律分析下面的推断,其中错误的是( )A.铍(Be)的氧化物的水化物可能具有两性B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于












