分)【化学选修 A-I为原子序数递增的前4周期的元素 已知A原子的最外层电子是次外层电子数的2倍 D
| 分)【化学选修 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找) (1)B单质分子中  键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。(2)H元素原子的价层电子排布式为____,H3+离 子可以与上述元素中的三种形成的某阴离子生成血红色 络合物;该阴离子又与A-I元素中的某些原子形成的分 子互为等电子体,这种分子的化学式为____(写一种即 可).该阴离子空间构型为____。 (3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____. 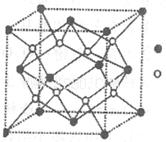 (4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为 ;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。 |
参考解答
| 37.(15分) (1)1:2(1分) O<N<F(1分) (2)3d64s2 (1分) CO2(CS2 N2O)等合理答案都可以(1分) 直线形(1分) (3)Ca (1分) 8 (1分) (4)ZnS (2分) 109o28′(1分) (5)74% (1分); 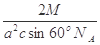 (2分) (2分) 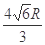 (2分) (2分) |
试题分析:A原子的最外层电子是次外层电子数的2倍,故A为碳,D为F,因为氟的电负性最强,则B为N、C为O,F和C在同一族,故F为硫,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故F和G在第IIA,为镁和钙,应用最广泛的金属H为铁,在第二副族的I为锌;(1)氮气中氮氮三键,有1条ɑ键,故为1:2,同周期第一电离能从左向右逐渐增大,但氮为半充满,稳定,第一电离能大于氧,故为O<N<F;(2)铁的价电子排布为3d64s2,铁离子与SCN-形成络合物,价电子总数为16,分析可得价电子总数为16的分子为 CO2或CS2 或N2O,分析SCN-的结构可得中心原子碳和硫原子形成一条单键和氮原子形成三键,碳原子共形成2条ɑ键,无孤对电子,故为sp1杂化,直线型;(3)黑点位于面心和顶点,8× 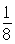 +6× +6×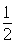 =4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a='b=2R,' c='1.633a,' a='b=90°,' g=120° =4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a='b=2R,' c='1.633a,' a='b=90°,' g=120°空间利用率=晶胞中球的体积/晶胞体积= 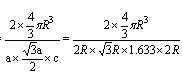 =74.06%;有三个晶胞构成的六棱柱的体积为3a2sin =74.06%;有三个晶胞构成的六棱柱的体积为3a2sin c,晶胞的质量为 c,晶胞的质量为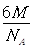 ,质量除以体积得密度为: ,质量除以体积得密度为: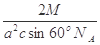 ; ;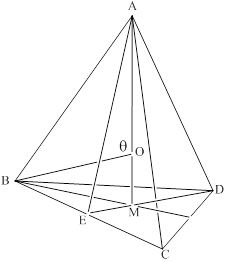 正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 : 正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :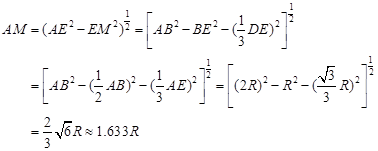 A3型晶胞中晶轴c 是2个四面体的高,即:c=2AM= 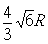 。 。 |
相似问题
据报道 放射性同位素钬(16667Ho)可有效地治疗肝癌 该同位素原子的核内中子数与核外电子数之差是
据报道,放射性同位素钬(16667Ho)可有效地治疗肝癌,该同位素原子的核内中子数与核外电子数之差是A.166B.67C.99D.32
短周期元素X Y Z在元素周期表中的位置如图所示 其中Y与Z的原子最外层电子数之比为2:1.下列说法
短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y与Z的原子最外层电子数之比为2:1.下列说法不正确的是A.X与Y只能形成两种化台物B.简单离子的半
短周期元素X Y Z W在元素周期表中的相对位置如图6所示 其中W原子的最外层电子数是最内层电子数的
短周期元素X、Y、Z、W在元素周期表中的相对位置如图6所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是A.原子半径:rW>rZ>rY>rXB
下列实验操作及现象与实验结论都正确且有因果关系的是选项实验操作及现象实验结论A分别点燃乙烯和乙炔 乙
下列实验操作及现象与实验结论都正确且有因果关系的是选项实验操作及现象实验结论A分别点燃乙烯和乙炔,乙炔产生的黑烟更浓乙炔的含碳量高于乙烯B在滴有
Se是人体必需微量元素 下列有关Se和Se的说法正确的是( ) A.Se 和Se所含电子数不
Se是人体必需微量元素,下列有关Se和Se的说法正确的是( )A.Se 和Se所含电子数不同B.Se和 Se是两种不同的核素C.Se和 Se 分别含有44和46个质子D.Se和 Se都含有34个中子












