(1)现有以下物质:①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaS
| (1)现有以下物质: ①NaCl溶液;②液态SO3;③乙醇(C2H5OH);④熔融的KNO3;⑤BaSO4固体;⑥干冰;Cu 其中:属于电解质的是______(用序号填写) (2)已知铜在加热条件下能与浓H2SO4反应,产物为CuSO4、SO2、H2O,写出该反应的化学方程式______,其中发生氧化反应的物质是______,用双线桥法表示出上述反应的电子转移的方向和数目: ______. (3)已知离子反应:RO3n-+6I-+6H+═R-+3I2+3H2O,试求RO3n-中R的化合价______. (4)一个完整的氧化还原反应方程式可以拆写成两个“半反应”,一个是氧化反应,一个是还原反应,如:2H++Zn=Zn2++H2↑拆写的结果是:氧化反应Zn-2e-=Zn2+还原反应2H++2e-=H2↑,据此,请将反应2Fe3++Cu=2Fe2++Cu2+拆写成两个“半反应”式,氧化反应:______,还原反应:______. (5)某溶液中只有Na+、Al3+、Cl-、SO42-四种离子.已知Na+、Al3+、Cl-的个数比为3:2:1,则溶液中Al3+与SO42-的个数比为______. |
参考解答
| (1)电解质为在水溶液或者熔融状态下能够导电的化合物,满足该条件的为:熔融的KNO3、⑤BaSO4固体, 故答案为:④⑤; (2)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)
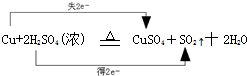 , ,故答案为:Cu+2H2SO4(浓)
 ; ;(3)RO3n-+6I-+6H+═R-+3I2+3H2O中一定满足电荷守恒,则+6-n-6=-1,解得n=1,则R的离子为:RO3-,设R的化合价为 x,则:x+(-2)×3=-1,解得:x=+5, 故答案为:+5; (4)2Fe3++Cu=2Fe2++Cu2+中铜失去电子,化合价升高发生氧化反应,反应的离子方程式为:Cu-2e-=Cu2+;铁离子得到电子,化合价降低被含有,发生还原反应,反应的反应为:2Fe3++2e-=2Fe2+, 故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+(或Fe3++e-=Fe2+); (5)溶液中只有Na+、Al3+、Cl-、SO42-四种离子,已知Na+、Al3+、Cl-的个数比为3:2:1,设Na+、Al3+、Cl-的个数分别为3x、2x、x,硫酸根离子的数目为y,则根据溶液电中性可知,3x+2x×3=x+y×2,解得y=4x,则溶液中Al3+与SO42-的个数比为:2x:4x=1:2, 故答案为:1:2. |
相似问题
现有中学化学中常见的几种物质:①O2 ②Mg ③CO ④WO3 ⑤W ⑥CO2.请回答下列问题:(1
现有中学化学中常见的几种物质:①O2、②Mg、③CO、④WO3、⑤W、⑥CO2.请回答下列问题:(1)①、②、③、④四种物质中常用作还原剂的有______(填序号
世界环保联盟即将全面禁止在自来水中加氯气(Cl2 黄绿色气体) 推广采用光谱高效消毒剂二氧化氯 目前
世界环保联盟即将全面禁止在自来水中加氯气(Cl2,黄绿色气体),推广采用光谱高效消毒剂二氧化氯,目前欧州和我国主采用Kesting法[原料为氯酸钠(NaClO3
从氧化还原角度分析 下列反应中水的作用相同的是( )①铁和水蒸气反应 ②过氧化钠和水反应③氯气和水
从氧化还原角度分析,下列反应中水的作用相同的是( )①铁和水蒸气反应 ②过氧化钠和水反应③氯气和水反应④二氧化氮和水反应3NO2+H2O=2HNO3+NO.A
在Cl2+2NaOH=NaCl+NaClO+H2O的反应中 有关说法错误的是( )A.Cl2既是氧
在Cl2+2NaOH=NaCl+NaClO+H2O的反应中,有关说法错误的是( )A.Cl2既是氧化剂又是还原剂B.每有1molCl2参加反应,就有2mol电子转移C.该反应可用于实
发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭.该火箭的主要燃料是偏二甲肼(用R表
发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭.该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应












