ZnSe是一种光电性能优异的半导体材料 人们开发出了多种制备ZnSe纳米粒子的方法.某研究小组用如下
ZnSe是一种光电性能优异的半导体材料,人们开发出了多种制备ZnSe纳米粒子的方法.某研究小组用如下方法制备了ZnSe纳米粒子: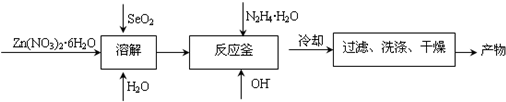 (1)SeO2能溶于水,溶解过程中的化学方程式:______; (2)硒酸(H2SeO4)的水溶液按下式发生一级和二级电离: H2SeO4=H++HSeO4-;HSeO4-  H++SeO42-,K2=1.0×10-2(298K) Na2SeO4溶液显______(填“酸性”、“中性”、“碱性”).理由______(用离子方程式表示) (3)已知肼(N2H4)有强还原性,在反应釜中与SeO32-反应的氧化产物是N2,请写出该反应的离子程式:______. (4)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用.该电池的正极反应式为______. |
参考解答
| (1)SeO2为酸性氧化物,与水反应生成H2SeO3,反应方程式为SeO2+H2O═H2SeO3,故答案为:SeO2+H2O═H2SeO3; (2)根据HSeO4-  H++SeO42-,K2=1.0×10-2(298K),可知Na2SeO4为强碱弱酸盐,SeO42-离子水解,溶液呈碱性,水解离子方程式为SeO42-+H2O═HSeO4-+OH-, 故答案为:碱性;SeO42-+H2O═HSeO4-+OH-; (3)在反应釜中反应物有Zn2+、SeO32-、N2H4,生成物有N2,SeO32-被还以为-2价的Se,与Zn2+生成ZnSe,根据氧化还原反应得失电子相等和质量守恒定律,离子方程式为 2Zn2++2SeO32-+3N2H4=2ZnSe+3N2↑+6H2O,故答案为:2Zn2++2SeO32-+3N2H4=2ZnSe+3N2↑+6H2O; (4)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故答案为:N2+6e-+8H+=2NH4+. |
相似问题
只有氧化性的离子是( )A.Cl-B.Fe2+C.MnO4-D.S2-
只有氧化性的离子是( )A.Cl-B.Fe2+C.MnO4-D.S2-
ClO2是一种消毒杀菌效率高 二次污染小的水处理剂.可通过以下反应制得ClO2:2KClO3+H2C
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4═2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是( )A
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中 在钢铁的表面形成一层四氧化三铁的技术过程.其中一种办
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程.其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混
在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中:(1)______元素化合价升高
在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中:(1)______元素化合价升高,______元素化合价降低.(填元素名称)(2)______是氧化剂,Cu发生了______反
Ⅰ.现有以下物质:①稀硫酸 ②钠 ③生石灰 ④无水酒精 ⑤空气 ⑥干冰 ⑦金刚石 ⑧纯
Ⅰ.现有以下物质:①稀硫酸②钠③生石灰④无水酒精⑤空气⑥干冰⑦金刚石⑧纯碱⑨NaOH晶体⑩熔化的K2SO4.(用序号回答)(1)以上物质中属于混合物的是_












