(12分)(1)环境专家认为可以用金属铝将水体中的NO转化为N2 从而清除污染。该反应中涉及的粒子有
(12分)(1)环境专家认为可以用金属铝将水体中的NO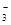 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH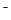 、Al(OH)3、NO 、Al(OH)3、NO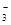 、N2,请将各粒子分别填入以下空格内(不用配平)。 、N2,请将各粒子分别填入以下空格内(不用配平)。 该反应过程中,被氧化与被还原的元素的物质的量之比为 。 (2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O= 4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。 (3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol Fe2O3(s)+  C(s)= C(s)=  CO2(g)+2Fe(s) △H=234.1kJ/mol CO2(g)+2Fe(s) △H=234.1kJ/molC(s)+O2(g)=CO2(g) △H=-393.5kJ/mol 写出铝与氧化铁发生铝热反应的热化学方程式 。 (4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: 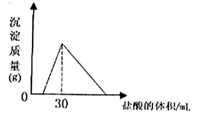 则反应过程中产生氢气的总体积为 L(标准状况)。 |
参考解答
(1)NO 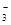 +Al+H2O→Al(OH)3+N2+OH- 5:3 +Al+H2O→Al(OH)3+N2+OH- 5:3(2)2H2O+O2+4e-=4OH- 铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。 (3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol (4)2.016 |
分析:(1)根据金属铝将水体中的NO3-转化为N2,可知Al元素的化合价升高,在反应中被氧化,N元素的化合价降低,在反应中被还原,利用电子守恒来计算; (2)根据电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应,再利用铂的性质及网状结构分析其优点; (3)根据已知的反应和盖斯定律来计算目标反应的反应热,并书写热化学反应方程式; (4)根据2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑、NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,结合图象来计算金属的物质的量,再利用电子守恒来计算氢气的物质的量,最后计算其体积. 解答:解:(1)由金属铝将水体中的NO3-转化为N2可知,在NO3-+Al+H2O→Al(OH)3+N2+OH-中,Al元素被氧化,N元素被还原,则被氧化与被还原的元素的物质的量分别为x、y,由电子守恒可知, x×(3-0)=y×(5-0), 解得x:y=5:3, 即被氧化与被还原的元素的物质的量之比为5:3,故答案为:5:3; (2)由电池总反应4Al+3O2+6H2O=4Al(OH)3可知,Al作负极,氧气在正极上得电子发生还原反应, 正极反应为2H2O+O2+4e-=4OH-, 又正极材料使用铂网,是因铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积, 故答案为:2H2O+O2+4e-=4OH-;铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积; (3)由①4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol, ②Fe2O3(s)+ 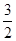 C(s)= C(s)=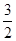 CO2(g)+2Fe(s)△H=234.1kJ/mol, CO2(g)+2Fe(s)△H=234.1kJ/mol,③C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol, 根据盖斯定律可知,①× 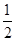 +②-③× +②-③×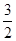 可得, 可得,2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol, 故答案为:2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol; (4)由2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑、NaOH+HCl═NaCl+H2O、 NaAlO2+HCl+H2O═Al(OH)3↓+NaCl可知, 反应后n(Na)=n(NaCl)=n(NaOH)+n(NaAlO2), 由图象可知,30mL盐酸生成沉淀最大,则n(NaCl)=n(HCl)=0.03L×2mol/L=0.06mol, 由合金全部溶解后得到20mol,pH=14的溶液,n(NaOH)=0.02L×1mol/L=0.02mol, 则n(Al)=n(NaAlO2)=0.06mol-0.02mol=0.04mol, 即合金中Na为0.06mol、Al为0.04mol,设反应过程中产生氢气的物质的量为n, 由电子守恒可知,0.06mol×1+0.04mol×3=n×2×1, 解得n=0.09mol, 所以在标况下其体积为0.09mol×22.4L/mol=2.016L, 故答案为:2.016. 点评:本题考查氧化还原反应、原电池、盖斯定律计算反应热、化学反应与图象的计算,难度较大,知识的综合性较高,(4)是学生解答中的难点,注意守恒法在解题中的重要作用. |
相似问题
下列氧化还原反应中 水作为氧化剂的是( )A.3NO2+H2O═2HNO3+NOB.CO+H2O
下列氧化还原反应中,水作为氧化剂的是( )A.3NO2+H2O═2HNO3+NOB.CO+H2O高温 CO2+H2C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
氧化还原反应与四种基本类型反应的关系如图所示 则下列化学反应属于阴影部分的是[ ]A.Cl2
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是[ ]A.Cl2+2KBr==Br2+2KCl B.2NaHCO3Na2CO3+H2O+CO2↑C.4Fe(OH)2+O2
在3Cl2+8NH3====6NH4Cl+N2中 发生氧化反应与还原反应的分子数比是( )A.2
在3Cl2+8NH3====6NH4Cl+N2中,发生氧化反应与还原反应的分子数比是()A.2∶3B.3∶2C.3∶8D.8∶3
下列叙述正确的是( )A.元素的单质可由氧化或还原含该元素的化合物来制得B.得电子越多的氧化剂
下列叙述正确的是()A.元素的单质可由氧化或还原含该元素的化合物来制得B.得电子越多的氧化剂,其氧化性就越强C.阳离子只能得到电子被还原,只
写出符合下列条件的氧化还原反应方程式A.一种单质氧化另一种单质B.一种单质氧化一种化合物C.一种化合
写出符合下列条件的氧化还原反应方程式A.一种单质氧化另一种单质B.一种单质氧化一种化合物C.一种化合物氧化另一种化合物D.一种化合物氧化一种单质












