(10分)用KMnO4氧化密度为1.19g/cm3 溶质的质量分数为36.5%的盐酸。反应方程式如下
| (10分) 用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的盐酸。反应方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O (1)用双线桥法标出上述反应中电子得失数目、化合价变化,并指出氧化剂和还原剂。 (2)求所用盐酸的物质的量浓度。 (3)15.8gKMnO4能使多少克HCl发生上述反应?产生的Cl2在标准状况下的体积为多少? |
参考解答
| (共10分) (1)  氧化剂:KMnO4 还原剂:HCl (2)解: 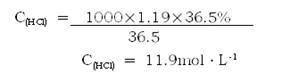 (3)设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。 2KMnO4 + 16HCl =' 2KCl' + 2MnCl2 + 5Cl2↑ + 8H2O 2×158 g 16×36.5 g 5×22.4 L 15.8 g x g y L  |
试题分析 :  氧化剂:KMnO4 (化合价降低 ) 还原剂:HCl (化合价升高) 由c=1000ρw/M得: 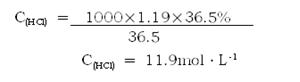 设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2。 2KMnO4 + 16HCl =' 2KCl' + 2MnCl2 + 5Cl2↑ + 8H2O 2×158 g 16×36.5 g 5×22.4 L 15.8 g x g y L  点评: 一、氧化还原反应的特点:氧化剂得电子,化合价降低,具有较强氧化性;还原剂失电子,化合价升高,具有较强还原性; 二、双线桥的表示基本步骤: 1.标变价 明确标出所有发生氧化还原反应的元素的化合价,不变价的元素不标化合价。 2.连双线 将标化合价的同一元素用直线加箭头从反应物指向生成物(注意:箭头的起止一律对准各元素) 3.标得失 ①标电子转移或偏离数 明确标出得失电子数,格式为“得/失 发生氧化还原反应原子个数×单位原子得失电子数” ②标化合价变化 一律标出化合价的变化,只有“化合价升高”“化合价降低”这两种写法,不可写为“升价”“降价”等 ③标出元素反应类型 一律标出元素所发生的反应,“被氧化”或“被还原”,其余写法均不正确 4.检查得失电子守恒 检查得失电子数是否相等,如不相等则重新分析。 |
相似问题
24 mL0.05 mol·L-1的Na2SO3溶液恰好与40 mL 0.02 mol·L-1的K2
24 mL0 05 mol·L-1的Na2SO3溶液恰好与40 mL 0 02 mol·L-1的K2RO4酸性溶液反应生成硫酸钠,则元素R在还原产物中的价态是( )A.+6B.+3 C.+2 D.0
金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式 A.方框中的物质应为 Cu
金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式A.方框中的物质应为 Cu2SB.若有1 molSO2 生成,则反应中有4 mol 电子转
NH4NO3受热分解产物为HNO3 N2 H2O 在此反应中发生氧化反应的氮原子与发生还原反应的氮原
NH4NO3受热分解产物为HNO3、N2、H2O,在此反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是A.3:5B.5:4C.5:8D.5:3
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂 其中主要反应之一的化学
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2=+2FeS+SO2(已配平),则下列关于
向氯酸钠的酸性水溶液中通入SO2 反应中氧化过程为:SO2+2H2O—2e-→SO42-+4H+;向
向氯酸钠的酸性水溶液中通入SO2,反应中氧化过程为:SO2+2H2O—2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:












