(10分)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:2KMnO4+16HCl(浓)
| (10分)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为: 2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O (1)请将上述化学方程式改写为离子方程式________________。 (2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。 ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (3)此反应中氧化产物是 (填化学式),产生0.5molCl2,则转移的电子的物质的量为______mol。 (4).用双线桥法表示该反应的电子转移的方向和数目 |
参考解答
| (1)2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O(2分) (2)②(2分) (3) Cl2(2分) 1 (2分)(4)略(2分) |
| (1)离子方程式为:2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O; (2)HCL在反应中CL元素的化合价部分升高即总分被氧化,部分不变作用酸性; (3)在氧化还原反应中还原剂生成氧化产物,即为Cl2,产生0.5molCl2,则转移的电子的物质的量为1mol。 (4) 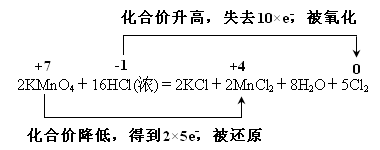 |
相似问题
已知:锌与很稀的硝酸反应生成硝酸锌 硝酸铵和水 则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比
已知:锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是A.1:4B.1:9C.1:8D.1:2
(CN)2 (OCN)2 (SCN)2等通称为拟卤素 它们的性质与卤素相似 氧化性强弱顺序是:F2>
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2下列方程式中错误的是
下列不能用于比较非金属元素的非金属性强弱的是( )A.单质间的置换反应B.气态氢化物的稳定性C.单
下列不能用于比较非金属元素的非金属性强弱的是()A.单质间的置换反应B.气态氢化物的稳定性C.单质在水中的溶解度的大小D.最高价氧化物对应水化物的
(14分)过氧化氢H2O2 (氧的化合价为-1价) 俗名双氧水 医疗上利用它有杀菌消毒作用来清洗伤口
(14分)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~F涉及H2O2的反应,回答相关问题:A.Na2O
下列反应属于氧化还原反应 但水既没有做氧化剂又没有做还原剂的是A.2F2+2H2O ='4HF' +
下列反应属于氧化还原反应,但水既没有做氧化剂又没有做还原剂的是A.2F2+2H2O = "4HF " +O2B.3NO2+H2O =2HNO3+NOC.2Na +2H2O=2NaOH+H2D.CaO+H2O =Ca(OH)2












