(7分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+ 常加入合
| (7分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。 A. KMnO4 B. H2O2 C. Cl2水 D. HNO3 然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去 Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。 A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2 (2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 |
参考解答
| (7分)(1)B CD (2)4 3.3 可行 |
(1)除杂的过程中不能引进新的杂质,H2O2为绿色氧化剂,产物为水;调节溶液pH不能引进新的杂质,用 CuO和Cu(OH)2即可。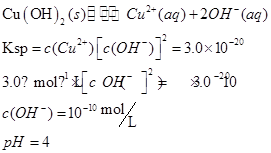 (2) 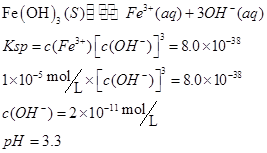 方案可行。 |
相似问题
下列反应中 氧化剂与还原剂物质的量关系为1∶2的是A.O3+2KI+H2O===2KOH+I2+O2
下列反应中,氧化剂与还原剂物质的量关系为1∶2的是A.O3+2KI+H2O===2KOH+I2+O2B.2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2C.I2+2NaClO3===2NaIO3
下列反应不属于四种基本反应类型 但属于氧化还原反应的是( )A.Fe + CuSO4 ='='
下列反应不属于四种基本反应类型,但属于氧化还原反应的是()A.Fe + CuSO4 ="=" FeSO4+ Cu B.AgNO3+ NaCl ="=" AgCl↓ + NaNO3C.MnO2 +
金属铜的提炼多从黄铜矿开始 已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为:
金属铜的提炼多从黄铜矿开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为: 2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是A
家用消毒柜常用臭氧(O3)消毒 在消毒过程中通过放电发生如下反应:3O2(g)=2O3(g)△H=+
家用消毒柜常用臭氧(O3)消毒,在消毒过程中通过放电发生如下反应:3O2(g)=2O3(g)△H=+144 8kJ mol;下列关于臭氧说法不正确的是A.O2和O3互为同素异形
(1)该反应中 被氧化的元素是____________ 氧化剂是____________。(2)写出
(1)该反应中,被氧化的元素是____________,氧化剂是____________。(2)写出该反应的化学方程式并标明电子转移的方向和数目:___________________________












