已知铜在常温下能被稀硝酸溶解 其反应的化学方程式如下3Cu+8HNO3═3Cu(NO3)2+2NO↑
| 已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下 3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O (1)用双线桥法分析上述反应(只需标出电子得失的方向和数目) (2)上述反应中氧化剂是______,氧化产物是______. (3)当生成0.5mol的 NO时,反应转移电子是______mol,同时还原的硝酸为______克. |
参考解答
(1)(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为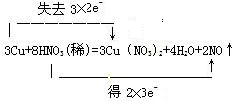 ,故答案为: 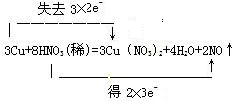 ; (2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物, 故答案为:HNO3,Cu(NO3)2; (3)根据化学方程式,当生成2molNO时,转移的电子为6mol,消耗硝酸8mol,在8mol硝酸中,只有2mol硝酸被还原,即被还原的硝酸是参加反应硝酸的量的
|
相似问题
化合物A是尿路结石的主要成分 属于结晶水合物 可用X?H2O表示.在一定条件下有如图(1)所示的转化
化合物A是尿路结石的主要成分,属于结晶水合物,可用X?H2O表示.在一定条件下有如图(1)所示的转化关系:已知:①经分析,图(1)中的各字母代表的物质
下列反应中 水既不是氧化剂 又不是还原剂的是( )A.C12+H2O=HCl+HClOB.2H2O
下列反应中,水既不是氧化剂,又不是还原剂的是( )A.C12+H2O=HCl+HClOB.2H2O通电 2H2↑+O2↑C.2Na+2H2O=2NaOH+H2↑D.2F2+2H2O=4HF+O2↑
下列反应中 有酸参加的氧化还原反应是( )A.HCl+NaOH═NaCl+H2OB.NaHSO4+
下列反应中,有酸参加的氧化还原反应是( )A.HCl+NaOH═NaCl+H2OB.NaHSO4+BaCl2═BaSO4↓+NaCl+HClC.Zn+H2SO4═ZnSO4+H2↑D.3Cl2+6KOH△ 5KCl+KClO3+3H2O
在以下涉及MnO2的反应中 其中MnO2做氧化剂的是:( )A.2KMnO4=K2MnO4+MnO
在以下涉及MnO2的反应中,其中MnO2做氧化剂的是:( )A.2KMnO4=K2MnO4+MnO2+O2↑B.MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2OC.2KClO3△ 2KCl+3O2↑D.2H2O2=2H2O+O2↑
在下列反应中 水仅作氧化剂的是( )A.2Na+2H2O=2NaOH+H2↑B.Cl2+H2O=H
在下列反应中,水仅作氧化剂的是( )A.2Na+2H2O=2NaOH+H2↑B.Cl2+H2O=HCl+HClOC.2F2+2HO=4HF+O2D.2H2O2=2H2O+O2↑












