技术的发展与创新永无止境 我国化学家侯德榜改革国外的纯碱生产工艺 生产流程可简要表示如图(1)向沉淀
| 技术的发展与创新永无止境,我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图 (1)向沉淀池中要通入CO2和氨气,应选通入______(填化学式).原因是______. (2)沉淀池中发生反应的化学方程式是______. (3)母液中的溶质主要是______.向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是______. (4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(填上述流程中的编号)的循环,物质X是______,从沉淀池中提取沉淀的操作是______. (5)写出煅烧炉中发生反应的化学方程式______. (6)这样制得的产品碳酸钠中可能含有的杂质是______(填化学式),为检验该杂质的存在,具体操作是______. 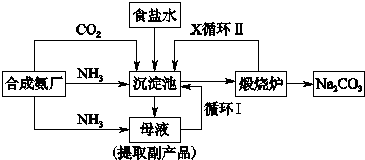 |
参考解答
| (1)二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳, 故答案为:NH3;二氧化碳在水中的溶解度较小,氨气极易溶于水,所以应该先通氨气有利于吸收二氧化碳; (2)氨气、二氧化碳、水和氯化钠发生反应生成碳酸氢钠和氯化铵,反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.故答案为:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓; (3)根据NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵.故答案为:NH4Cl;增大铵根离子浓度,使氯化铵更多析出; (4)循环Ⅰ是将未反应的氯化钠返回沉淀池中,煅烧碳酸氢钠时生成二氧化碳、二氧化碳能循环利用,所以X是CO2,从固液混合物中分离出固体的方法为过滤.故答案为:Ⅰ;CO2;过滤; (5)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、水和二氧化碳,反应方程式为 2NaHCO3
(6)可能含有氯化钠杂质,氯离子能和硝酸酸化的硝酸银反应生成白色沉淀,所以检验氯离子的方法为:取少量试样溶解,加用硝酸酸化的硝酸银溶液,若有白色沉淀说明含有氯化钠,否则,没有氯化钠,.故答案为:NaCl;取少量试样溶解,加用硝酸酸化的硝酸银溶液,若有白色沉淀说明含有氯化钠,否则,没有氯化钠. 故答案为:(1)NH3;因为CO2溶解度较小,而NH3易溶于水,先通NH3有利于CO2吸收 (2)NH3+CO2+NaCl+H2O═NaHCO3↓+NH4Cl (3)NH4Cl; 增大NH4+浓度,使NH4Cl更多析出 (4)Ⅰ;CO2;过滤 (5)2NaHCO3
(6)NaCl; 取少量试样溶解,加用HNO3酸化的AgNO3溶液,若有白色沉淀,说明含有NaCl杂质. |
相似问题
自然界中存在着氧循环 碳循环 水循环等。下图为水循环 其中A B C是水循环中水的三种自然状态 A
自然界中存在着氧循环、碳循环、水循环等。下图为水循环, 其中A、B、C是水循环中水的三种自然状态,A为密度最大时的状态。D能支持燃烧并能与许多物质发
下图是常见物质转化关系图(个别产物可能略去)。其中A B常温下均为液态 且组成元素相同;F是大理石的
下图是常见物质转化关系图(个别产物可能略去)。其中A、B常温下均为液态,且组成元素相同;F是大理石的主要成分。Y为氧化物,Z是紫红色固体。 请回答下
下列变化不能通过一步反应实现的是( )A.KNO3→KClB.Zn→AgC.CaCl2→CaCO3
下列变化不能通过一步反应实现的是( )A.KNO3→KClB.Zn→AgC.CaCl2→CaCO3D.Na2CO3→NaOH
现有A B C D四种物质。A是无色无味的气体 B在A中剧烈燃烧 火星四射 放出大量热 同时生成一种
现有A、B、C、D四种物质。A是无色无味的气体,B在A中剧烈燃烧,火星四射,放出大量热,同时生成一种黑色固体C。D是一种无色的气体,把D通入澄清的石灰水
某固体氧化物X 经过①②两步反应后 得到红色固体单质C 溶液B只含一种溶质 且是盐。反应物和产物均已
某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐。反应物和产物均已给出。 (1)第①步盐酸是否过量?__________,












