图中A~J分别代表一种反应物或生成物 已知A受热分解得到等物质的量的B C D气态物质 图中部分生成
图中A~J分别代表一种反应物或生成物,已知A受热分解得到等物质的量的B、C、D气态物质,图中部分生成物未列出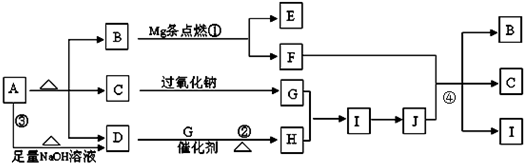 请回答: (1)B的结构式______,D分子的空间构型为______; (2)写出反应①、④的化学方程式 ①______; ④______; (3)写出反应③的离子方程式______; (4)写出有C参加的且C只做还原剂的氧化还原反应化学方程式______; (5)将D和G以1:2混合在催化剂的作用下充分反应后无气体剩余,则生成溶液中溶质的质量分数______ (用分数表示). |
参考解答
| A在加热的条件下能与NaOH反应生成D为常温下气态物质,说明A为铵盐,D为NH3,A分解得到等物质的量的B、C、D, B为常温下为气体,又能与镁反应,考虑B为CO2,C能与过氧化钠反应,考虑C为H2O,G为O2,则A为NH4HCO3, 氨气与氧气反应生成NO,NO与氧气反应生成NO2,H为NO,I为NO2,则J为HNO3,镁与二氧化碳反应生成MgO与C,C与浓硝酸反应生成CO2、NO2、H2O,E为MgO,F为碳,符合转化关系, (1)由上述分析可知,B为CO2,碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,D为NH3,N原子形成3个N-H单键,含有1对孤对电子,采取sp3杂化,分子的空间构型为三角锥型,故答案为:O=C=O,三角锥型; (2)反应①是镁在二氧化碳中燃烧生成氧化镁与碳,反应方程式为:2Mg+CO2
反应④是碳与浓硝酸反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO3 (浓)
故答案为:2Mg+CO2
(3)反应③是碳酸氢铵与氢氧化钠反应生成氨气、碳酸钠、水,离子方程式为:NH4++HCO3-+2OH-═NH3↑+CO32-+2H2O, 故答案为:NH4++HCO3-+2OH-═NH3↑+CO32-+2H2O; (4)有H2O参加且只做还原剂的氧化还原反应,为氟气与水反应生成HF与氧气,反应方程式为2F2+2H2O=4HF+O2, 故答案为:2F2+2H2O=4HF+O2; (5)将NH3和O2以1:2混合在催化剂的作用下充分反应,没有无气体剩余,发生的总反应式为:NH3+2O2=HNO3+H2O,生成的HNO3与H2O的物质的量之比为1:1,故生成硝酸溶液中溶质的质量为
|
相似问题
下列物质为中学常见物质 它们具有如下转化关系:对它们有如下的推断:①X不可能是单质;②X一定是化合物
下列物质为中学常见物质,它们具有如下转化关系:对它们有如下的推断:①X不可能是单质;②X一定是化合物;③若n=2,则XYn+1可能是FeCl3;④若n=l,则XYn
A经如图所示的过程转化为含氧酸D.(1)若A在常温下为非金属固体单质 B是能使品红溶液褪色的有刺激性
A经如图所示的过程转化为含氧酸D.(1)若A在常温下为非金属固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体.①D的化学式是______;B的化学式是
A B C D E均为中学化学的常见单质或化合物 它们之间的反应关系如图所示: (1)若A是短周期中
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示: (1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶
物质A-G均由短周期元素组成 A B为非金属气体单质 B原子最外层电子数比次外层电子数的2倍还多1。
物质A-G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1。 甲、乙均为金属单质,且甲的原子半径在第三周期最大
已知甲 乙 丙 X是4种中学化学中常见的物质 其转化关系符合下图。则甲和X不可能是 [
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X不可能是[ ]A.甲:C、X:O2 B.甲:SO2、X:NaOH溶液 C.甲:Fe、X:Cl2












